器質的な疾患で説明不能な筋力低下・骨痛・全身痛をみたときに骨軟化症を想起し、ALP上昇・低P血症がないか検査する。
原因としてビタミンD欠乏、腫瘍性骨軟化症、X連鎖性低リン血症くる病・骨軟化症が多い。
低リン血症時のFGF23>30pg/mLはFGF23関連低リン血症を示唆する。
はじめに
くる病は成長軟骨帯閉鎖前の小児のみに生じる特有の骨成長障害であり特徴的な骨格変形を起こす。骨軟化症は年齢や原因に関係ない骨の軟化であり小児と成人に発生する。くる病は軟骨と成熟した骨基質の石灰化がうまくできず、成長板の関与もあり低身長となる。一方で骨軟化症は成熟した層板骨の石灰化不全によって起こる。
4つの代表的な代謝性骨疾患では、骨粗鬆症が飛び抜けてコモンだが、くる病と骨軟化症は合わせて2番目に多い代謝性骨疾患である。ついで変形性骨炎(別名、骨ページェット病)、嚢胞性線維性骨炎(副甲状腺機能亢進症によって生じる骨疾患だが極めてまれ)に続く。
ビタミンDの発見後すぐにくる病と骨軟化症はビタミンD投与で治療可能な疾患となった。しかしFGF23の発見とそのリンの尿細管における再吸収とビタミンD代謝における重要な役割の理解によって、いくつかの遺伝性および後天性くる病・骨軟化症は遺伝子や表現型の特徴で分類されるようになった。FGF23関連のくる病・骨軟化症は通常のビタミンD治療に反応せず、耐性を示すことが多い。
| くる病・骨軟化症 | 骨粗鬆症 | 線維性骨炎 | 変形性骨炎 | |
|---|---|---|---|---|
| 基本的異常 | 軟骨と骨の石灰化不全 | 正常な層状骨の不十分な置換 | 線維性骨と線維組織による置換 | 異常な線維性骨 |
| 有病率 | 2番目に多い | 最も一般的 | まれ | それほどまれではない |
| 血清Ca | 正常/低 | 正常 | 高/非常に高 | 正常 |
| 血清P | 正常/低/非常に低 | 正常 | しばしば低 | 正常 |
| ALP | 高 | 正常/高 | 高/非常に高 | 高 |
| PTH | 高 | 正常/高 | 高/非常に高 | 正常 |
| 25D | 低/正常 | 正常/低 | しばしば低 | 正常/低 |
| 皮質の減少 | あり、ただしX連鎖性低リン血症を除く | 時々 | あり | なし |
| 椎骨の変形 | 双凹形または魚形 | くさび形/圧縮 | 様々 | 拡大 |
| 長骨の変形 | 弯曲と偽骨折 | なし、ただし脆弱性骨折を除く | 褐色腫 | 弯曲とストレス骨折 |
歴史的背景
くる病
くる病の最初の報告は1645年であった。17世紀半ばにはすでにくる病は産業革命と都市化の拡大(おそらく日照暴露が少ないこと)、母乳中のビタミンD不足に起因するとされていた。日照でくる病が治療できるという「概念の証明」がされたのは20世紀初めであった。20世紀初めのくる病の報告はほとんどがビタミンD欠乏が蔓延している地域からであり、ほとんど全ての症例が栄養性ビタミンD欠乏が原因だった。現在の牛乳や他の食品へのビタミンD添加の政策によって、ビタミンD欠乏性のくる病・骨軟化症は先進国ではほぼ無くなった。その結果、遺伝性および後天性のくる病・骨軟化症が一般的となった。
骨軟化症
骨軟化症はもともと骨が軟化し、障害を伴う変形を引き起こす状態を指していた。その病因と治療に関する包括的な報告は1896年に遡る。以前の論文では骨軟化、リウマチ性、梅毒性、老年性、さらに神経性骨軟化症などが骨軟化症を記述する際に使われており、骨の病気が感染や炎症によると考えられていたことが示唆される。骨端線に主に影響するくる病と全身の骨に影響を及ぼす骨軟化症との区別は18世紀には認識されていた。
疫学
世界的にはビタミンD欠乏とカルシウム欠乏が最も多いくる病・骨軟化症の原因である。
他の代謝性骨疾患と異なり、くる病・骨軟化症の正確な有病率は不明である。
最近の報告では栄養欠乏によるくる病・骨軟化症は増加傾向にあることが示唆され、ビタミンD欠乏性くる病は1980年には2.2/10万人だったが、2000年には24/10万人であったとされる。またビタミンD欠乏による成人の骨軟化症は肥満症に対する肥満手術による吸収不良によって増加している可能性がある。肥満手術後の骨軟化症の発生率に関する正確なデータはないが、ミシガン州デトロイトでは肥満手術が骨軟化症の最も多い原因であったとされる。
先進国ではビタミンD欠乏性くる病や骨軟化症が稀であるため、遺伝性くる病や後天性くる病・骨軟化症の有病率が高くなる。
最も多い遺伝性くる病・骨軟化症(XLH)は2万人に1人の割合で発症する。
骨リモデリングと石灰化
骨リモデリングは、一生を通じて古い骨が新しい骨に置き換わり骨格の完全性を維持するために必要なメカニズムである。正常な骨リモデリングでは古い骨と新しい骨は同量置き換わるが、加齢や疾病ではリモデリングが不十分となる。骨粗鬆症は正常な層状骨が置換されるがその量が不十分なため起きる。副甲状腺機能亢進症による線維性骨炎では線維性骨と線維組織による置換が起こる。変形性骨炎では異常な線維性骨の局所産生によって置換される。骨軟化症では石灰化されていない骨基質(類骨)によって置換される。
このように骨代謝性疾患は置換される骨の違いによって区別される。
骨が適切に石灰化されるためには2つの条件が必要になる。1つは骨芽細胞による成熟した層状骨基質の合成。もう1つはPTHとビタミンDによって調節される最適なカルシウムとリンの生成物に新しく合成された層状骨基質が曝露されることである。
正常な骨石灰化は2段階からなり、1次石灰化である急速相では数日から数週間以内に最大ミネラル含有量の75-80%が沈着する。2次石灰化である緩徐相では数ヶ月かけて約90-95%に達する。
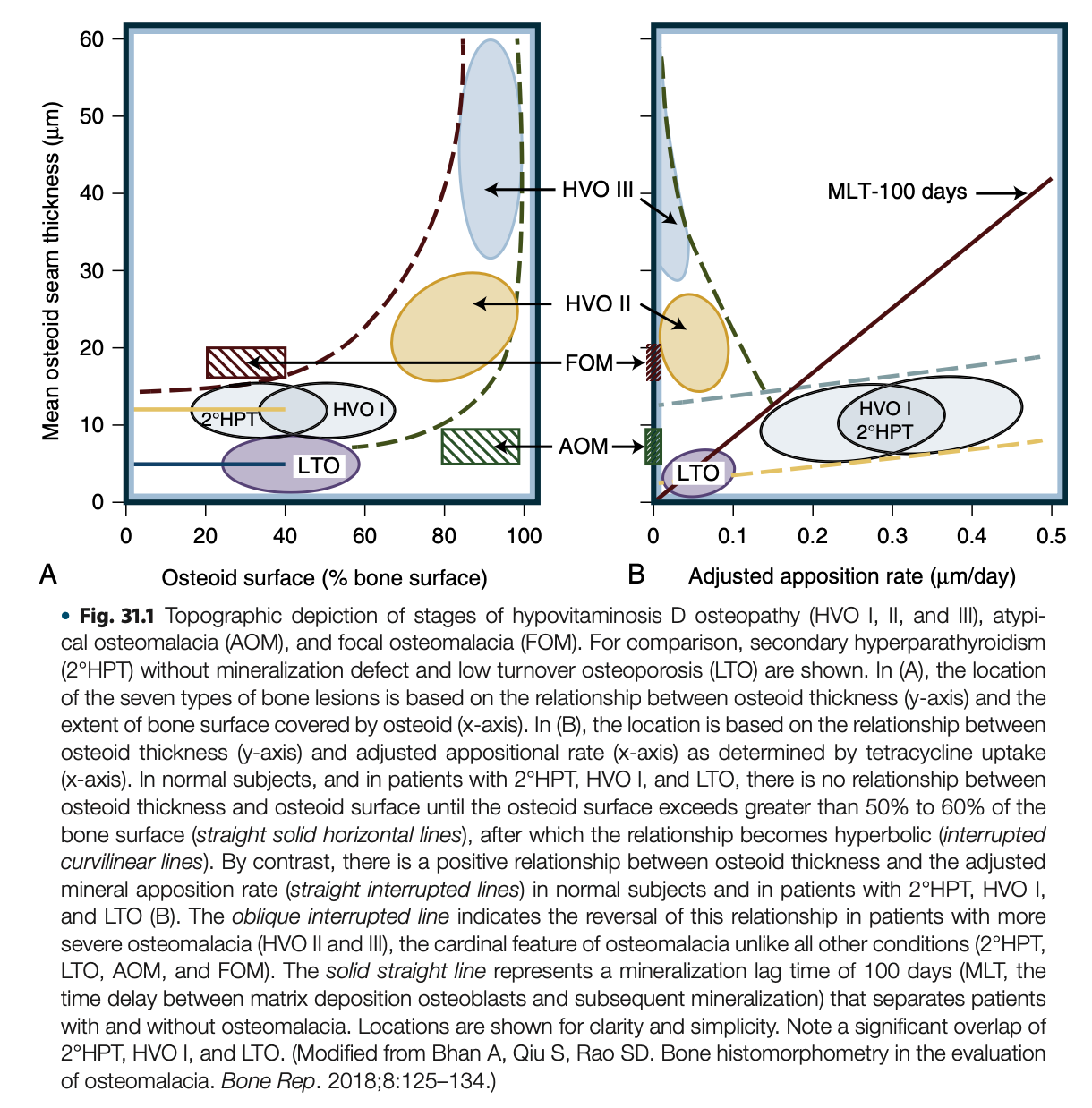
骨軟化症の定義と組織的進展
古典的なビタミンD欠乏性骨軟化症は、原因によらず3つの段階で進行する。
第1段階は二次性副甲状腺機能亢進症による骨リモデリングの亢進を特徴とし、類骨の表面積と体積は増加するが、厚くはならず、石灰化も正常に行われる。この段階は低ビタミンD骨症1期(hypovitaminosis D osteopathy stege 1; HVO1)または前骨軟化症と呼ばれる。同様の所見はビタミンD欠乏を伴わないカルシウム吸収不良の患者(二次性副甲状腺機能亢進症; 2°HPT)にもみられるが類骨量はHVO1より少ない。
2°HPT・HVO1ともにPTH過剰による皮質骨の減少が認められるが、基本的に無症状であり、時に脆弱性骨折を起こす。血清P・Caは正常で、ALPは必ずではないが、だいたい上昇している。25Dは低値(<10ng/mL)で血清PTHと1,25Dは上昇している。ALPと1,25Dの増加は二次性副甲状腺機能亢進症による骨回転の増加と腎臓における1α水酸化酵素活性化による。
HVO2と呼ばれる第2段階は類骨の蓄積がさらに進み、表面積・体積・厚さの全てが増加するが、ある程度の石灰化は維持されている。この段階で血清P・Caは通常低下している。患者は骨痛、筋力低下、脆弱性骨折や偽骨折を呈することがある。
HVO3と呼ばれる第3段階では、石灰化が止まり、骨表面の90%以上を類骨が覆うようになる。血清Ca値を保つために必要である骨吸収に対して類骨は抵抗性であるため、低Ca血症は必発となる。骨表面が類骨で広く覆われるのは、骨の完全な溶解を防ぐための生体の防御機構と考えられる。より重篤な副甲状腺機能亢進症の特徴である骨梁周囲や骨髄の線維化はこのHVO3期のみで起こり、骨生検で証明される。患者は常に症候性であり、びまん性骨痛・筋力低下・偽骨折を伴う。時に骨痛を伴わない筋力低下を主訴とする患者もいる。
骨膜が12.5µmを超え、石灰化遅延時間が100日以上で定義される骨軟化症は従来の臨床的・画像的骨軟化症の記述と一致する。
遺伝性・後天性低リン血症性骨軟化症の患者のほとんどはHVO3期に相当する、経過の後半に症状を呈するため、残念ながらその経過に関して、ビタミンD欠乏性骨軟化症のようなデータはない。
原因
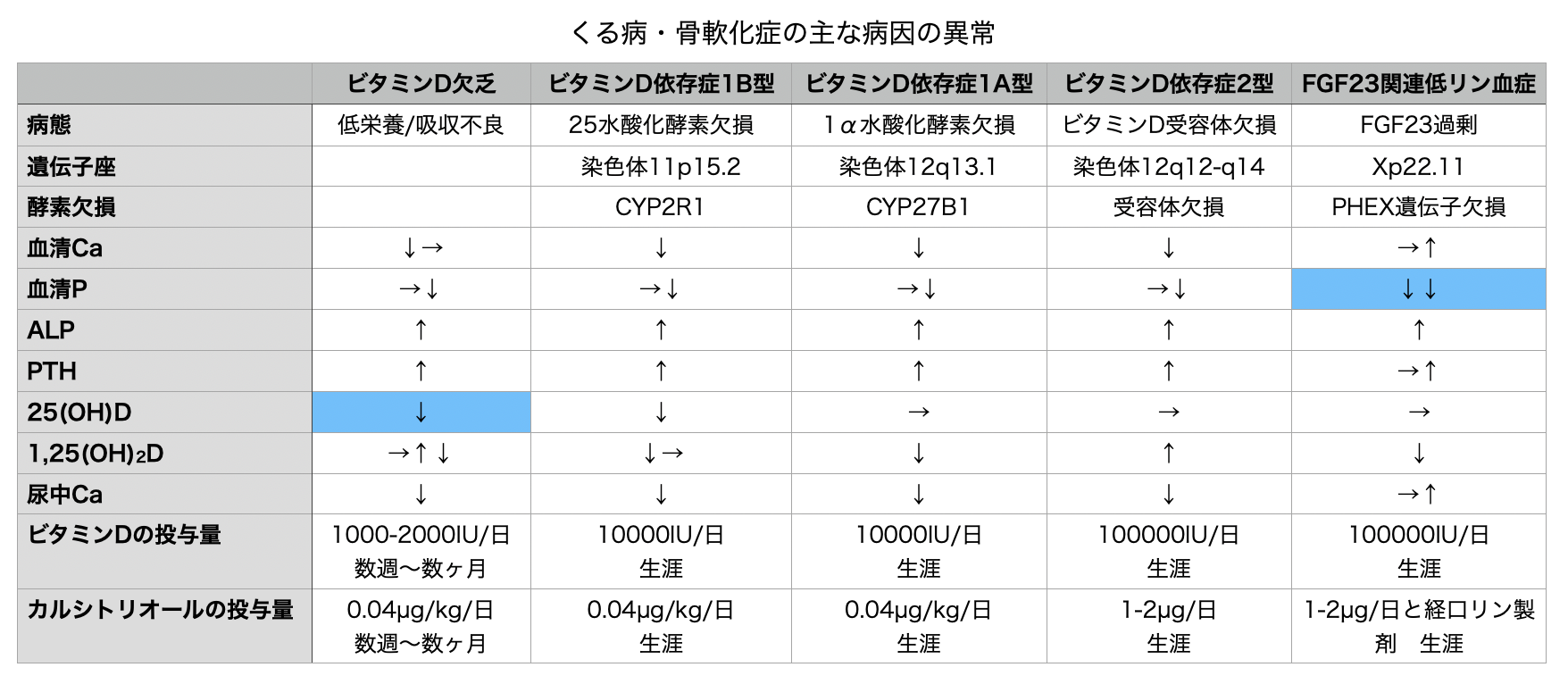
くる病・骨軟化症が発症する3つのメカニズムは①ビタミンD欠乏、②リン欠乏、③カルシウム欠乏でこの順番に多い。
リン摂取不足によるくる病・骨軟化症は非常に稀であり、長期間経腸栄養投与を受けている患者でたまに症例報告されることがあるレベルである。
ビタミンD欠乏は長期化したり無治療のままだと、最終的にくる病・骨軟化症を起こす。
リン欠乏はその原因(遺伝性、腫瘍性、後天性)を問わず2番目に多いくる病・骨軟化症の原因であり、ビタミンD欠乏が蔓延していない地域でも最も多い原因である。低リン血症性くる病・骨軟化症の一般的な2つの原因は遺伝性低リン血症とFGF23産生腫瘍である。その他の稀な原因としてリン結合性制酸薬の長期使用、様々な遺伝性・後天性の尿細管障害がある。
さらに稀だが、組織学的に異なるものとしてフッ化ナトリウム・エチドロネート、アルミニウムなど骨石灰化を直接阻害する薬剤の毒性によって生じる非典型的・局所的骨軟化症がある。
ビタミンD欠乏性くる病・骨軟化症
ビタミンD欠乏の原因には外因性と内因性がある。外因性は皮膚のビタミンD3産生の欠乏や低栄養による。日照不足、日焼け止め、濃い色素の皮膚、文化的理由によって衣服で肌を隠す、加齢などが全て皮膚のビタミンD3産生を低下させる。内因性のほとんどは腸疾患や切除、バイパス術によって腸管からのビタミンD吸収が障害されることによって起こる。またビタミンD欠乏は遺伝的または後天的な肝臓の25水酸化酵素障害・欠損、腎臓やその他の標的組織の1α水酸化酵素の障害・欠損によっても生じる。
病的肥満に対する胃全摘術、胃部分切除術、迷走神経切断術、幽門形成術、腸切除術、胃バイパス術、腸管バイパス術は全てビタミンD欠乏と骨軟化症と関連している。CaやビタミンDを含む複数の栄養素の吸収不良のため、骨の表現系は単純な骨密度低下から骨軟化症まで様々である。
消化器疾患や術後の患者の骨軟化症の頻度は不明だが、最大50%に達する可能性もある。
長期にわたる二次性副甲状腺機能亢進症は骨髄線維症や高Ca血症・三次性副甲状腺機能亢進症を引き起こすことがある。一方で胆道系や膵疾患は骨粗鬆症の原因にはなるが、骨軟化症を起こすことが稀である。また25水酸化酵素の十分な機能的予備能のため、肝疾患に伴ってビタミンD欠乏が起きることもない。ビタミンD摂取不足、肝炎に対する抗ウイルス薬、PBCの合併によって重篤なビタミンD欠乏や骨軟化症を起こすことはある。
ビタミンD欠乏性くる病・骨軟化症の原因
外因性
ビタミンD摂取不足
日照不足または回避(日焼け止め・過度の衣服)
内因性
加齢による皮膚のビタミンD産生低下
消化管障害による吸収不良
胃切除(部分、全、バイパス手術)
小腸疾患、切除、またはバイパス
セリアック病(グルテン過敏症)
胆汁性肝硬変(まれ)
膵不全(嚢胞性線維症を含む)(まれ)
肝臓での25水酸化障害
?未熟児
?新生児肝炎
?肝硬変
ビタミンD依存症1B型
腎臓での1α水酸化障害
慢性腎不全
ビタミンD依存症1A型
ビタミンDの代謝亢進
抗てんかん薬(フェニトイン、リファンピシンなど)
カルシウム欠乏性くる病
くる病と骨軟化症の両方を起こすビタミンD欠乏症やリン欠乏と異なり、カルシウム欠乏はくる病だけを起こすことが証明されている。カルシウム欠乏が骨粗鬆症を起こすことは知られているが、カルシウム欠乏による成人の骨軟化症は1例も報告されていない。カルシウム摂取量が200mg/日を下回るとビタミンDの栄養状態に関わらずくる病を発症するリスクがある。カルシウム欠乏性くる病はビタミンD欠乏性くる病よりも遅く発症する傾向があり、ナイジェリアの報告では平均4歳、他の報告では4-16歳と幅がある。
カルシウム欠乏性くる病の臨床的特徴として特に青年期において成長板の変形が多くないが、顕著なX脚を呈することである。
先進国でカルシウム欠乏性くる病が少ないのは、食事からのカルシウム摂取量が多いのと、母乳育児が長くないことが関連しているかもしれない。くる病で25Dが正常の小児を診た場合に、特に低Ca血症とPTH上昇があれば、カルシウム欠乏性くる病を考えるべきである。
リン欠乏性くる病・骨軟化症
リン摂取不足によるくる病・骨軟化症は非常に稀である。リンは食品、果物、野菜、乳製品に豊富に含まれていて、腸管からの吸収も受動的で非常に効率的だからである。
血清リン濃度はPTHとFGF23の制御下で腎臓によって狭い範囲内で維持される。
低リン血症は入院患者、鉄欠乏、リン結合剤や制酸剤を使用している患者においては珍しくないが、くる病や骨軟化症を引き起こすほど長くは続かない。よって低リン血症性くる病・骨軟化症はほとんどが遺伝性か後天性である。
低リン血症性くる病・骨軟化症の原因
遺伝性
常染色体顕性低リン血症性くる病
常染色体潜性低リン血症性くる病
X染色体顕性低リン血症性くる病(XLH)
X染色体潜性低リン血症性くる病
高Ca尿症を伴う遺伝性低リン血症性くる病(Dent病)
線維性骨異形成症
遺伝性Fanconi症候群
後天性
腫瘍性骨軟化症(TIO) *後天性で最多
腎尿細管障害 or 非遺伝性Fanconi症候群
パラプロテイン血症
ウィルソン病
ガラクトース血症
チロシン血症
糖原病
アルコール多飲
薬剤性
テノホビル・アデホビル *後天性で2番目に多い
鉄剤の経静脈的長期投与
アルコール
リン吸着剤
カドミウム中毒
臨床所見
くる病と骨軟化症の症状は主に筋骨格系に関連している。いくつかの例外を除いて、原因に関わらず臨床所見は一緒である。くる病は成長板に影響するため、低身長を呈する。
また骨格の変形が一般的にみられる。長管骨においてくる病は骨幹の弯曲(O脚・X脚)、骨端線の拡大・毛羽たち、骨幹端の杯状陥凹を起こすが、骨軟化症では長管骨の骨幹のみに影響が出る。くる病の経過がなく、後年に骨軟化症を発症した場合、臨床症状は軽微で、加齢に伴う骨粗鬆症に似ている。一般的に、骨軟化症の発症が遅ければ遅いほど、その臨床的な所見は見逃されやすく、症状は老化に伴う痛みとして軽視される可能性が高い。最も多い症状は骨痛、筋力低下、歩行困難、骨格の変形、骨折である。手足のひきつけ、筋痙攣、低Ca血症によるけいれんは一般的でないが、成人の骨軟化症よりは小児のくる病でみられる。
骨痛
骨軟化症の骨痛はびまん性の深部の鈍痛で、部位の特定は難しい。関節よりも骨の痛みのほうが多く、両側対称性のことが多い。その曖昧な症状のため、骨痛は緊張型頭痛(いわゆる骨軟化症性頭痛)、狭心症(肋骨の偽骨折による胸痛)、関節リウマチ、線維筋痛症と誤診される。痛みは持続的かつ不快であり、歩行時の体重負荷や筋収縮によって悪化し、休息でも改善しない。痛みは通常、腰背部から始まり、骨盤・臀部・大腿・上背部・肋骨へと広がるが、脛骨や腓骨に偽骨折が存在しない限り、膝下にはほとんど影響しない。
骨痛は類骨によって骨膜が引き伸ばされることによって起こると考えられている。骨粗鬆症患者では骨折しない限り、骨痛は出現しないが、骨軟化症では骨折がなくても骨痛が生じる。
筋力低下
近位筋、特に下肢の筋力低下は骨軟化症において最も多い筋症状である。上肢の筋力低下も身体診察で認められる。筋力低下の程度は慎重な身体診察でのみ認められる程度から重篤な筋疾患のmimicになるような重度の筋力低下まで様々である。
軽度の筋力低下は骨痛によって患者が立ったり歩くことを躊躇することと区別する必要がある。腕を使わずに座位から立ち上がることや階段昇降が困難な場合は特異的な所見である。
ひどい筋力低下でも、筋萎縮は一般的にない。筋の低緊張があってもfasciculationやクローヌスはない。腱反射は正常か亢進している。これらの所見は筋疾患との鑑別に役立つ。
筋力低下は低Ca血症や二次性副甲状腺機能亢進症に起因すると考えられているが、高Ca血症を伴う原発性副甲状腺機能亢進症や三次性副甲状腺機能亢進症でも認められる。
筋力低下は低リン血症性骨軟化症の特徴でもある。低Ca血症、低P血症、副甲状腺機能亢進症が筋力低下に相対的に及ぼす影響は分かっていない。一般に、筋力低下は低リン血症性骨軟化症でより顕著で、骨痛はビタミンD欠乏性骨軟化症によくみられる。興味深いことに、X連鎖性低リン血症(XLH)の患者は顕著な筋力低下にも関わらず骨量・骨サイズ・推定骨強度は正常または増加している。
骨格の変形と骨折
骨格の変形はくる病の小児では一般的であり、永続的に残る可能性がある。一方で成人発症の骨軟化症では骨折しない限り、骨格の変形は起こらない。
乳児では大泉門が開き、長頭症、前頭隆起、肋骨念珠(複数の肋骨の連続性対称性偽骨折による)、ハリソン溝(胸筋の弱さによる横隔膜レベルでの明瞭な水平線)、手関節や足関節の腫脹(広がった骨端線による)、二重外果(double malleoli)などが認められる。
歩行開始後は長管骨の弯曲、X脚、O脚、windswept deformityが認められる。
骨格の変形は通常、遺伝性低リン血症くる病でより重篤になり、主に下肢に影響を及ぼし、不均等な低身長を起こす。脆弱性骨折も珍しくないが、くる病・骨軟化症の診断的画像異常であるLooser zone(偽骨折)はよくみられる。偽骨折は骨の長軸に対して垂直な線状の透過帯であり、ストレス骨折である。偽骨折は荷重がかかる大腿骨転子下や中足骨では完全骨折に進展することがある。肋骨骨折もよくみられる。くる病の小児の骨は脆いというよりは柔らかいので骨折することは少ない。逆に成人の骨軟化症では骨折することが多い。
血液検査異常
全てのくる病・骨軟化症でALPの上昇が80-90%と最も多く、最初に認められる異常であるが、ALP正常の骨軟化症患者も稀にいる。低Ca血症は比較的遅い段階で認められるが、くる病の小児では成人の骨軟化症より早く認められる。軽度から中等度の低Ca血症(7.0-8.5mg/dL)は基本的に無症状であり、6.0mg/dL以下にならない限り症状は出ないが、重要なのは絶対値ではなく変化の速度である。最も重要なこととして、低リン血症性くる病・骨軟化症では特定の腎尿細管障害の患者を除いて、血清Ca値は常に正常である。
血清P濃度は常に変動しているため特異性は低い。日内変動、食事摂取、腎機能、PTHに影響を受けるため、ビタミンD欠乏性くる病・骨軟化症では血清P濃度は低値・正常、ときに高値となりうる。食事摂取の影響を受けるため、血清P濃度は朝空腹時に測定すべきである。定義として低リン血症性くる病・骨軟化症患者は血清P濃度が2.5mg/dL未満となる。
定義としてビタミンD欠乏性くる病・骨軟化症患者では25OHビタミンD濃度が10ng/mL未満と低値だが、25OHビタミンD濃度が低値の患者が全員くる病・骨軟化症を発症するわけではない。1,25OHビタミンDはビタミンD欠乏性くる病・骨軟化症のステージ、25OHビタミンDの可用性、PTH上昇の程度に依存するため、高値・正常・低値いずれもとりうる。一方で低リン血症性くる病・骨軟化症では低値であることが多い。
PTHはビタミンD欠乏では常に上昇しており、低リン血症性ではビタミンD欠乏が共存していない限り正常のことが多い。ただし経口リン製剤治療を受けている低リン血症性くる病・骨軟化症の患者では、PTHは徐々に上昇し、一部の患者では三次性副甲状腺機能亢進症を呈することがある。
画像検査の特徴
骨格の変形、椎体の変形、偽骨折(Looser zone)が一般的に認められる。
長管骨皮質の全般的な菲薄化はPTHによる骨皮質吸収によって生じる最初の放射線的異常となる。骨膜下骨吸収(中節骨、中手骨、中足骨の橈側によく認められる)と褐色腫は重度の副甲状腺機能亢進症を伴う患者でみられる。ビタミンD補充で後者の異常は改善する可能性があるが、骨皮質の菲薄化は改善しないため、治療後も骨折リスクは高い。
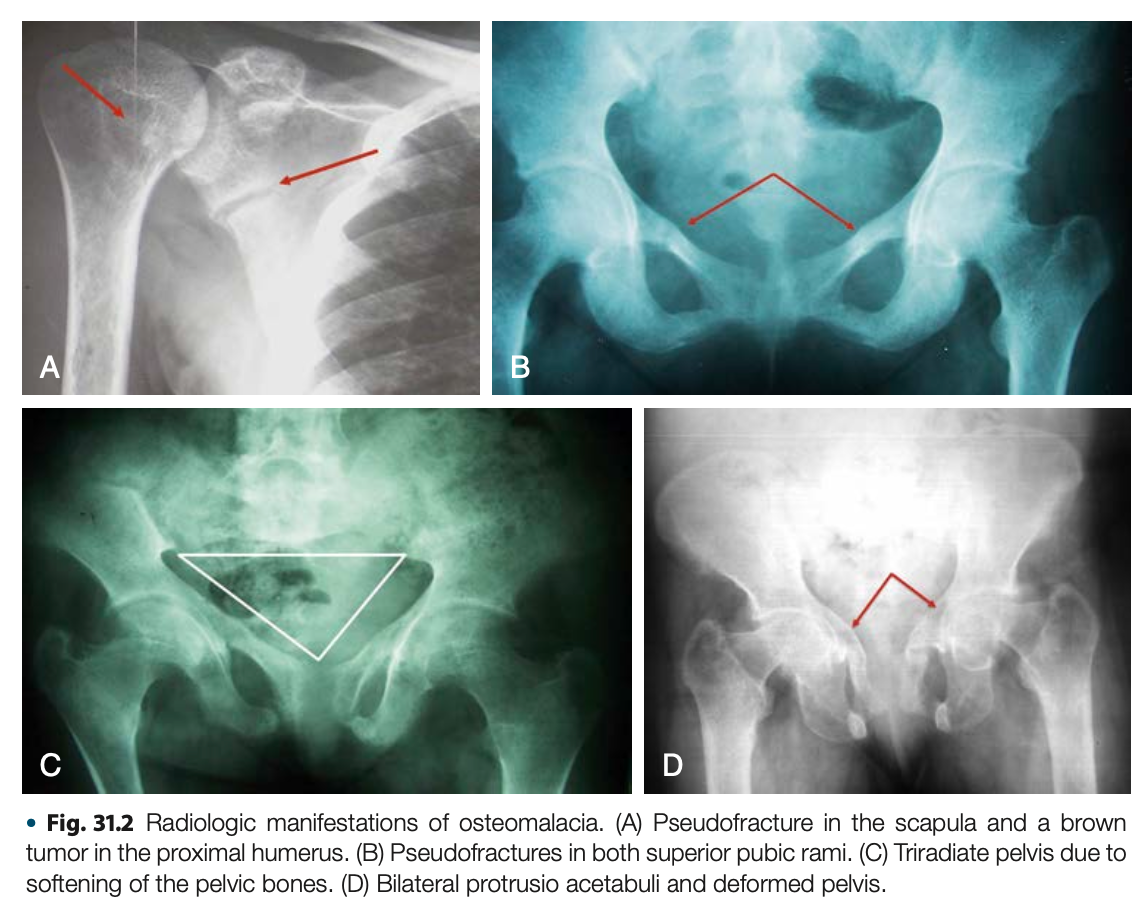
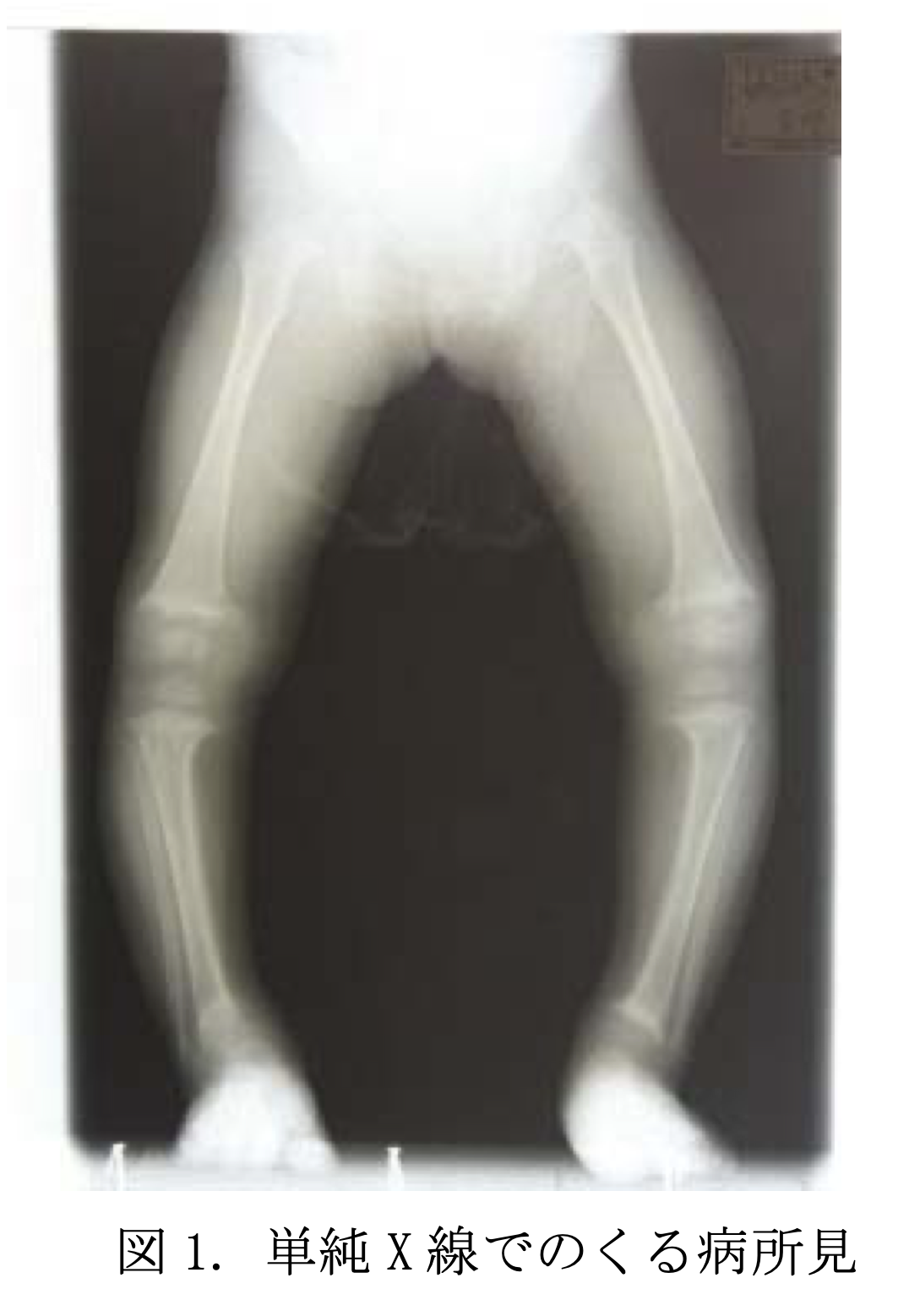
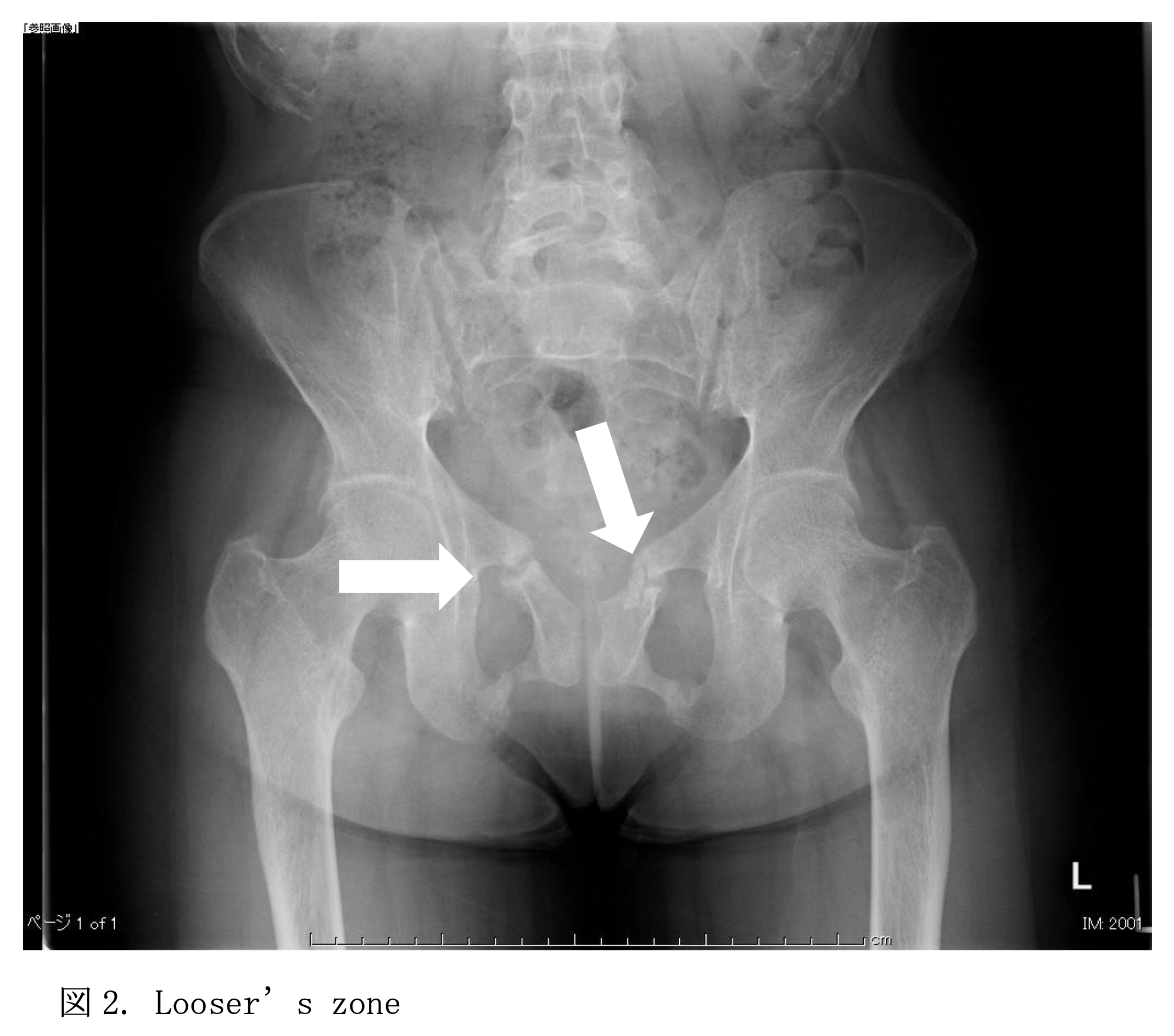
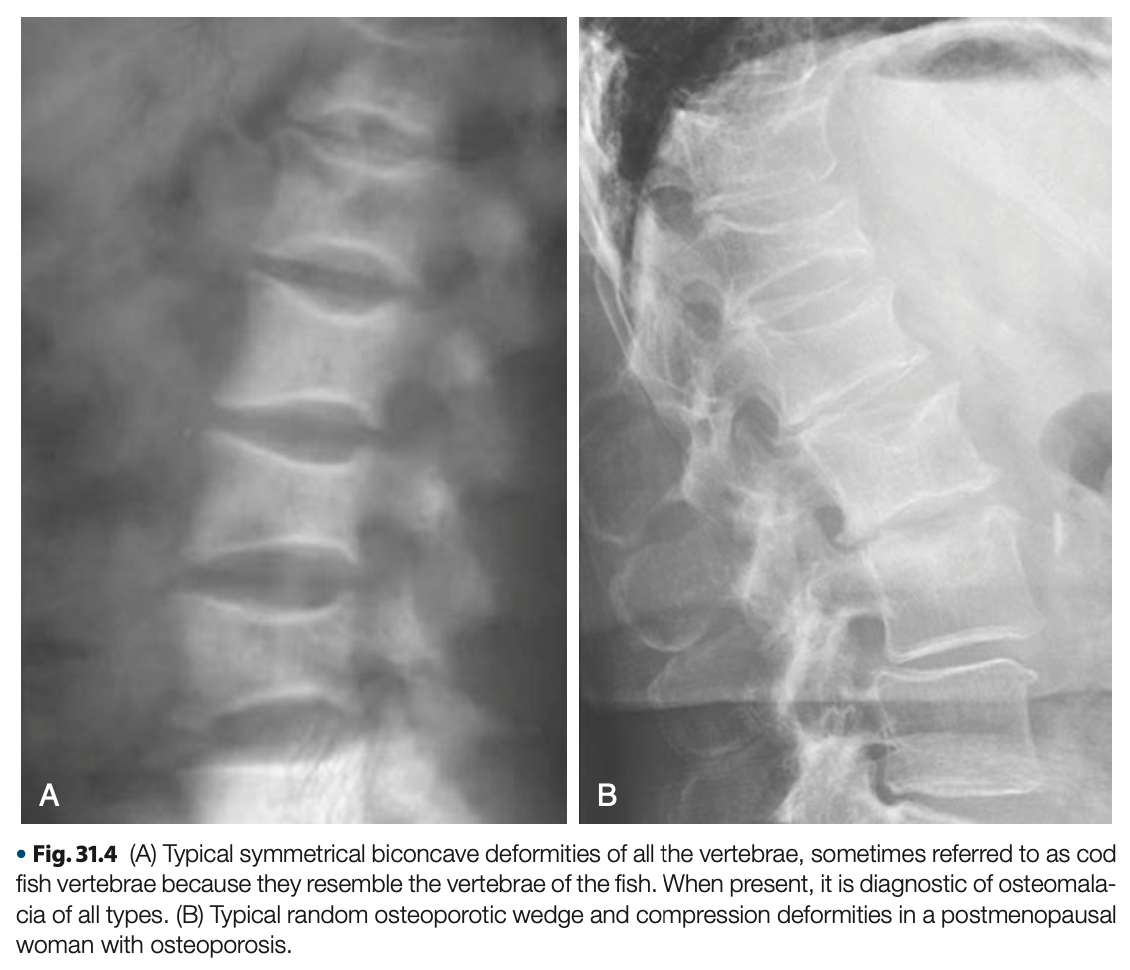
椎体の対称的な凹みが全椎体に生じ得る。椎間板の圧力による柔らかい椎体の陥没は魚の口様となる。この特徴的な椎体の画像所見は、骨粗鬆症でみられるようなランダムな前方楔形や非対称性の変形と対照的であり、cod fish様の椎体は骨軟化症の診断的所見となる。
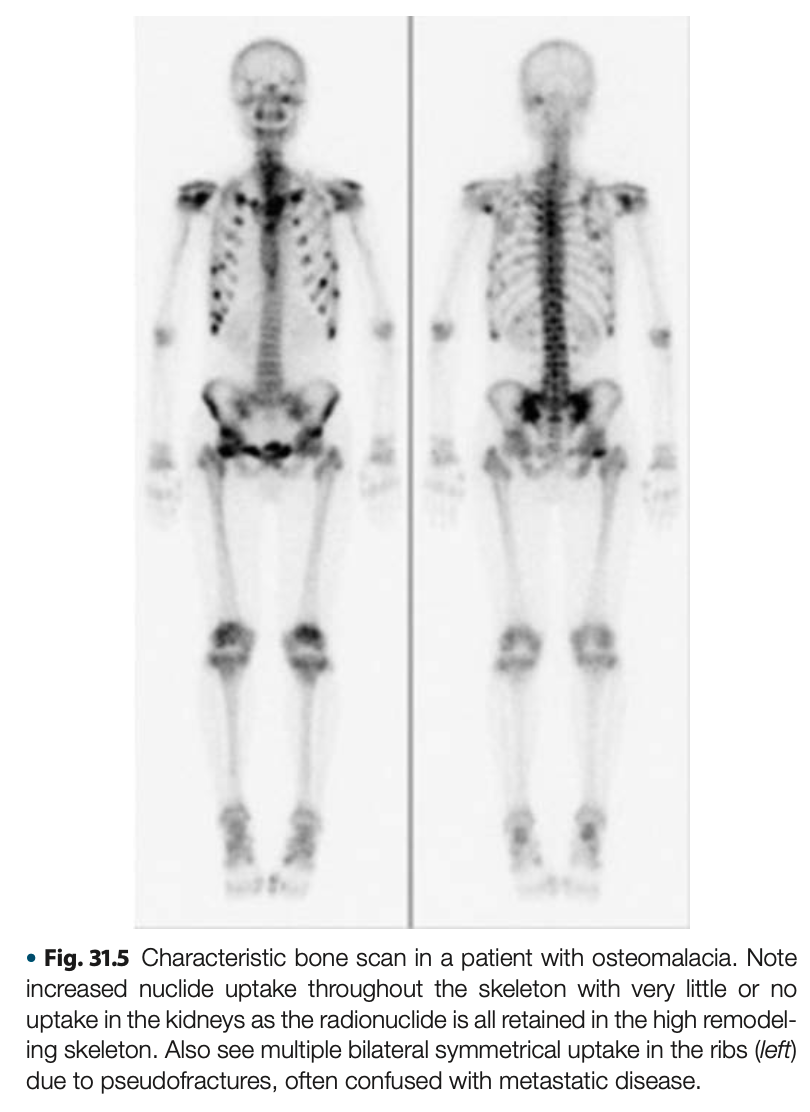
骨シンチグラフィーでの全般的な取り込み増加は骨回転の増加と関連していいるが、骨軟化症ではよく認められる。偽骨折はhot spotになる。骨格全体に取り込まれると、腎排泄が低下し腎臓の取り込みがほとんどなくなる。
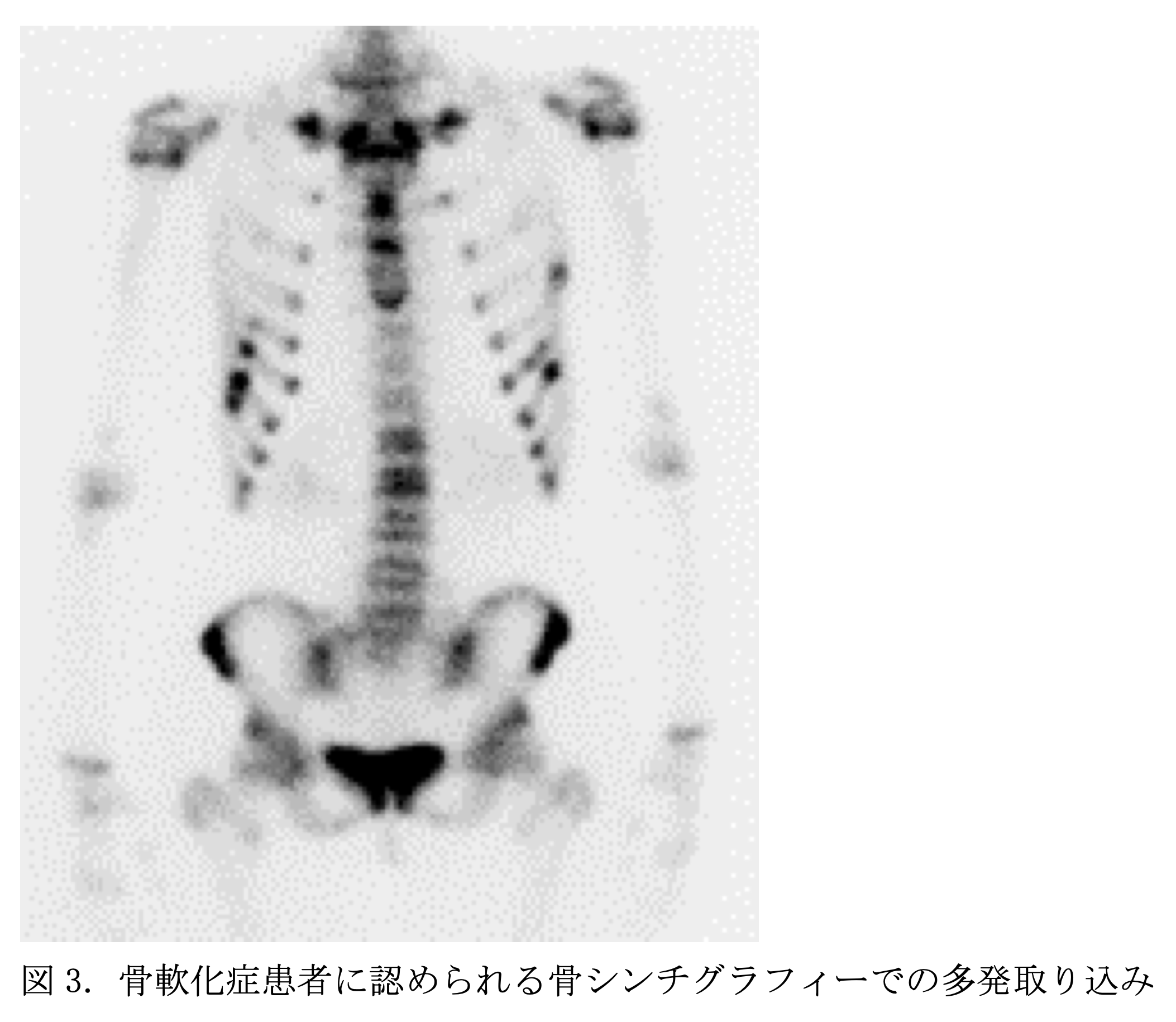
いくつかの例外を除き、ほとんどの画像的特徴はくる病。骨軟化症の種類を問わず共通している。XLHでは長管骨皮質の菲薄化はなく、むしろ肥厚していることが多い。同様に腱付着部症がXLHのみにみられるがその理由は不明である。
骨密度
二重エネルギーX線吸収測定法(DEXA)によって評価される骨密度は全部位で低下しており、特に皮質骨が多い前腕部でより低下する。一方でXLHの骨軟化症の成人では椎体の骨密度が正常か増加していることがある。骨密度の低下は骨粗鬆症でも認められるため、その区別に使用できない。骨軟化症疑いの患者において診断を確定するためのゴールドスタンダードはテトラサイクリン二重標識後の骨生検である。
診断
くる病の診断
大項目
(a)単純X線像でのくる病変化(骨幹端の杯状陥凹、または骨端線の拡大や毛羽立ち)
(b)高ALP血症*
小項目
(c)低P血症、または低Ca血症*
(d)臨床症状
O脚・X脚などの骨変形、脊柱の弯曲、頭蓋癆、大泉門の開離、肋骨念珠、関節腫脹のいずれか
*年齢に応じた基準値を用いて判断する。
くる病:大項目2つと小項目2つを満たすもの
くる病の疑い:大項目2つと小項目1つを満たすもの
骨軟化症の診断
大項目
(a)低P血症、または低Ca血症
(b)高骨型ALP(BAP)血症
小項目
(c)臨床症状:筋力低下または骨痛
(d)骨密度:YAM80%未満
(e)画像所見
骨シンチグラフィー:肋軟骨などへの多発取り込み
単純X線:Looser’s zone(偽骨折)
骨軟化症:大項目2つと小項目3つを満たすもの
骨軟化症の疑い:大項目2つと小項目2つを満たすもの
除外すべき疾患:癌の多発骨転移、腎性骨異栄養症、原発性副甲状腺機能亢進症
骨石灰化障害を惹起する薬剤使用例では、くる病・骨軟化症いずれにおいても、低P血症または低Ca血症の存在を除いて判断する。
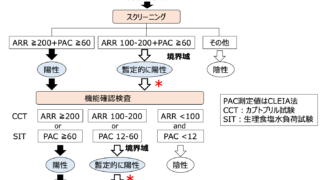
くる病・骨軟化症の病因鑑別フローチャート
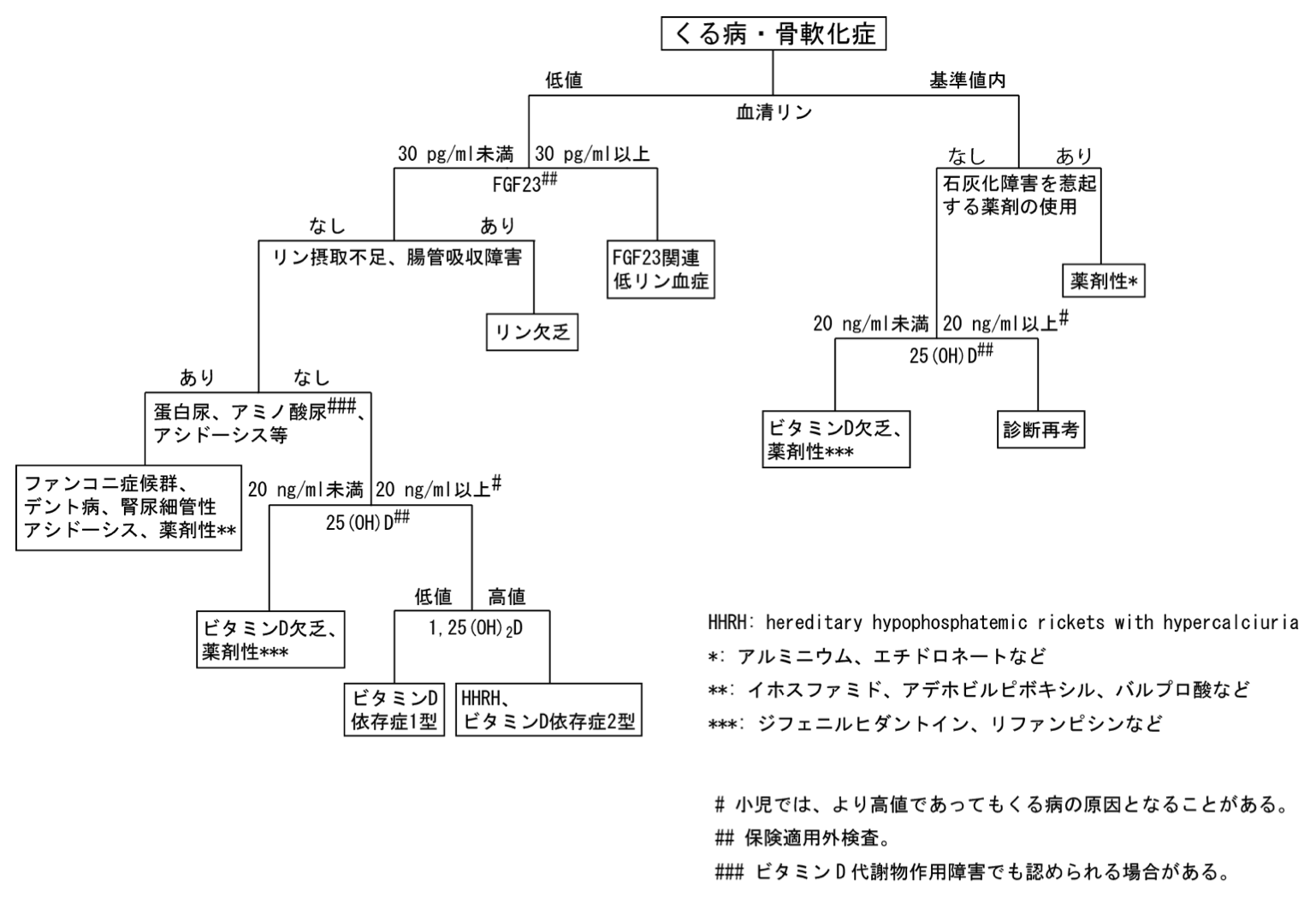
FGF23は2019年10月からFGF23関連低リン血症性くる病・骨軟化症の診断・治療において測定が保険適応となっている。
各論と治療
ビタミンD欠乏性くる病・骨軟化症
すべてのくる病・骨軟化症の治療において1つの決められたレジメンを存在しないため、患者毎にレジメンや用量を検討する必要がある。また中等度から重度のビタミンD欠乏やカルシウム欠乏の患者では最初により高用量のビタミンDとカルシウム補充が必要となる。
また治療開始後数週から数ヶ月で患者の症状の改善は得られ、数ヶ月から数年かかる生化学的、画像的、組織的改善よりも早い。治療により治癒したように見えても、皮質骨の不可逆的減少により患者は生涯骨折のリスクが高い。また長期経過した患者では治療後も二次性副甲状腺機能亢進症は続き、時には三次性副甲状腺機能亢進症を呈することがある。
中等度から重度の症候性ビタミンD欠乏性くる病・骨軟化症患者では50000IU/週のエルゴカルシフェロール(VitD2)またはコレカルシフェロール(VitD3)を8-12週間投与し、その後1000-2000IU/日の維持量に移行する。経過中に血清と尿中のCa・P濃度、PTH、25OHビタミンD濃度を測定しながら補充量を調節する。目標は25OHビタミンD>30ng/mLかつPTHが正常範囲内にする。活性型ビタミンD(カルシトリオール、アルファカルシドール)はビタミンD欠乏の治療において望ましくはないが、実際に使われている。活性型ビタミンDはPTHを早く抑制する以外に治療上のメリットはない。吸収不良がある患者では高用量のビタミンD(10000-50000IU/日)が補充に必要になるかもしれない。治療開始数ヶ月後は高Ca血症、高Ca尿症などに注意してフォローアップする。
くる病・骨軟化症を起こすほどのビタミンD欠乏では腸管からのCa吸収が減り、カルシウムが不足している可能性が高いので、経口カルシウム製剤(1000-1500mg/日)分割投与を併用する。治療後に骨粗鬆症の治療をする場合は必ず骨軟化症の所見が治癒し、二次性副甲状腺機能亢進症が改善していることを確認する。
ビタミンD代謝の遺伝子異常によるくる病
ビタミンD依存性くる病 type 1A, 1B, 2
ビタミンDの活性に関与する酵素の機能障害を起こす、3つの遺伝性くる病がある。
1979年に高用量のビタミンD補充に抵抗性の骨軟化症が初めて報告された。
ビタミンD依存性くる病Type1Bは1α水酸化酵素の欠失、Type1Aは25水酸化酵素の欠失、Type2はビタミンD受容体(VDR)の欠失である。1α水酸化酵素の障害はCKDや種々の尿細管障害、FGF23過剰産生などの後天的原因でも起こりうる。
Type1Aは稀な常染色体潜性遺伝疾患であり1,25OHビタミンD濃度が低下する。くる病は生後1年以内に発症し、低身長・筋緊張低下・筋力低下・けいれん・テタニー・大泉門離開・口腔内・歯の異常がみられる。Type1Aも1Bも1,25OHビタミンDであるカルシトリオールの生理量(0.04µg/kg/日)に反応する。Type2はさらに高用量のビタミンDを必要とする。Type2の小児は脱毛を合併するため、Type1Aや1Bとの区別となる。脱毛の程度も様々で頭部だけであったり、全身だったりする。興味深い事に高用量のビタミンDやリンの投与に生化学的・画像的異常は反応するが、脱毛は改善しない。
Type1AはビタミンD欠乏と同様に25OHビタミンDが低値となるため、ビタミンD欠乏と誤診されやすい。家族歴、ビタミンD補充に反応しない場合にこの稀なType1Aを疑う必要がある。全てのビタミンD依存性くる病はくる病と二次性副甲状腺機能亢進症を治療するためにビタミンDに加えてカルシウムとリン製剤を内服する必要がある。
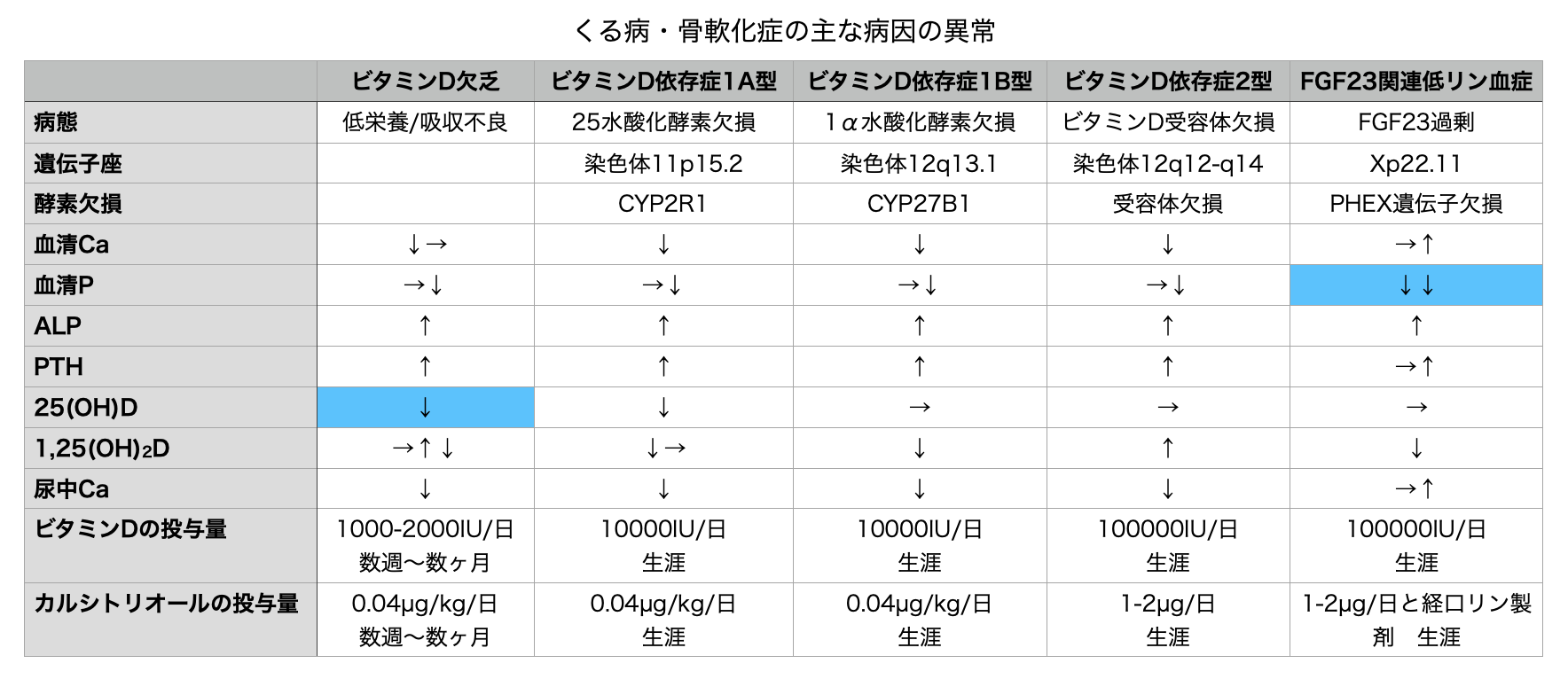
遺伝性低リン血症性くる病・骨軟化症
過去にはビタミンD抵抗性くる病とされていたが、遺伝性、低リン血症・Ca値正常、FGF23産生かどうかで分類されるようになった。このタイプで最も多いのはX連鎖性低リン血症性くる病・骨軟化症(XLH)である。
常染色体顕性・潜性遺伝性くる病
常染色体顕性低リン血症性くる病(ADHR)はFGF23遺伝子の変異によって発症する。
常染色体潜性低リン血症性くる病(ARHR)はdentin matrix protein(DMP1)とectonucleotide pyrophosphates/phosphodiesterase(ENPP1)遺伝子の不活性化変異によってそれぞれ1型と2型が発症する。
X連鎖性潜性低リン血症性くる病
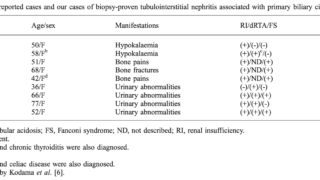
稀な遺伝性低リン血症性くる病でDent病として知られ、近位尿細管障害を伴うFanconi型を合併する。染色体Xp11.22とX25の変異で起こる。2つの型があり、1型(50-60%)はchloride channel 5(CLCN5)遺伝子の不活性化変異によって生じ、2型(~15%)はoculocerebrorenal syndrome(OCRL)遺伝子の不活性化変異によって生じる。デント病は他のFanconi症候群と同様に高Ca尿症と様々な近位尿細管障害、腎石灰化、腎結石、低分子量の尿蛋白、進行性腎障害を伴うがくる病を呈する患者は少ない。近位尿細管障害として尿糖、リン、尿酸、カリウム、重炭酸、アミノ酸が尿から検出される。Dent病は腎石灰化や腎結石を伴う遺伝性くる病であるが、くる病の中で最も稀な原因である。
X連鎖性低リン血症性くる病・骨軟化症
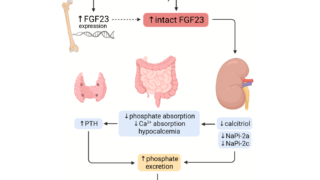
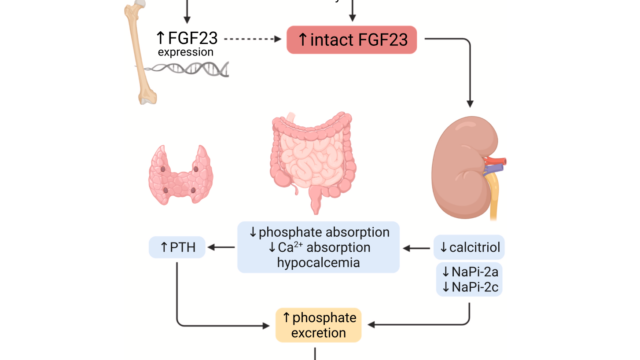
XLHはX連鎖性顕性疾患であり、20000出生に1人と最も多い遺伝性くる病である。the phosphate-regulating gene with homologies to endopeptidases on the X chromosome(PHEX)遺伝子の不活性化変異によって起こる。PHEXは骨と歯の細胞表面に発現している。PHEXの基質はよく分かっていない。PHEXの変異は300以上報告されていて、いくつかの患者の変異はde novo発生している。PHEX遺伝子変異によってXLH患者では骨でのFGF23産生が亢進していると考えられている。TIO・XLH・ADHRは全て類似した表現型を持っているが、リンの尿細管再吸収障害による低リン血症という点で共通している。正常な生理条件下で血清中のFGF23濃度がPHEXによる蛋白分解で調節されていることが示されている。FGF23濃度が過剰な場合は近位尿細管におけるリンの再吸収が低下し、低リン血症を起こす。XLH患者のようにPHEXが非活性の場合、FGF23は分解されずに血液中に蓄積する。ADHRではミスセンス変異がFGF23の重要なアミノ酸を置き換え、蛋白分解に抵抗性となり血中FGF23濃度の上昇が起きる。同様にTIOは腫瘍によるFGF23の異所性産生によって生じる。このようにFGF23が明らかにこれらの疾患で中心的な役割を果たしている。
XLHの臨床的特徴は様々であり、小児期にほとんどの患者はくる病を呈する。小児発症のXLHでは脚の弯曲や低身長などの骨格の変形が一般的。成人になると、XLHは血液検査の低P血症などで偶発的に見つかることがある。成人の症状は、骨痛・偽骨折、筋力低下、腱付着部症に関連する神経学的合併症、異所性石灰化などである。加えて、象牙質とエナメル質の微小欠陥による根部膿瘍などの歯科疾患が発生することがよくある。
画像と生化学所見
すべての遺伝性くる病の画像所見は栄養欠乏性くる病と似ているが、骨幹端の病変がやや非対称で、脚の湾曲が多い。成人ではほとんどの患者が肥満で、下肢の短縮がより顕著な不均衡な低身長を呈する。これらの所見は他のくる病と区別できるほど特異性は高くないが、腱付着部症はXLHのみに発症し、他のタイプのくる病・骨軟化症ではほとんどみられない。
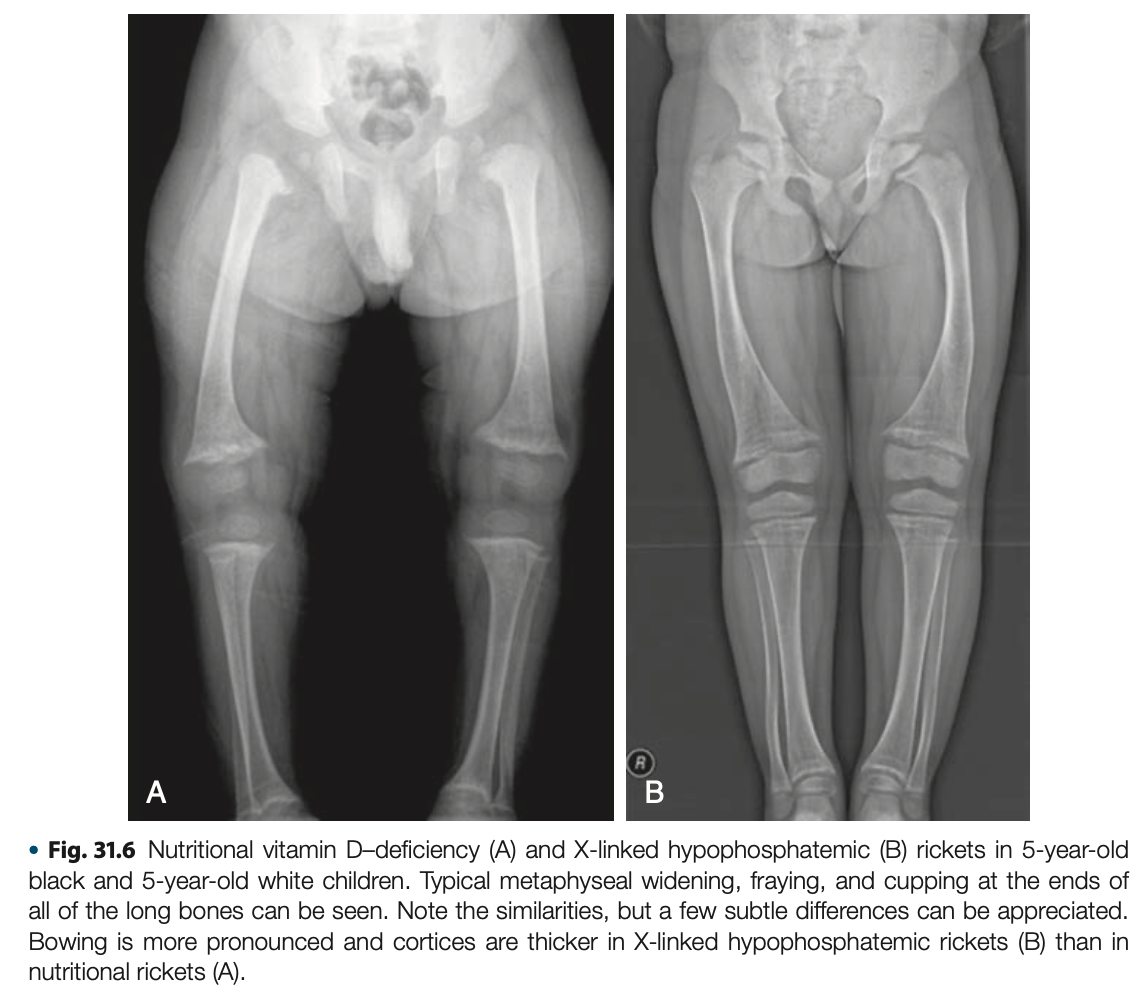
生化学所見では低リン血症、TmP/GFRで評価される腎のリン再吸収の低下、ALP上昇が一貫して認められる。血清Ca値、25OHビタミンD、PTHは無治療下では正常である。血清FGF23濃度は慢性的な低リン血症に関わらず、不適切に上昇している。
これらの臨床的・生化学所見の組み合わせは診断的であるが、XLHの鑑別疾患には栄養性くる病、骨端異形成症、生理的な弯曲、その他の腎リン排泄障害が含まれる。
慢性低リン血症+不適切なFGF23上昇(>30pg/mL)はFGF23関連低リン血症の可能性が非常に高い。くる病・骨軟化症の家族歴がなくてもPHEX遺伝子のde novo変異の可能性があるのでXLHは除外できない。XLHの臨床診断において遺伝子検査は必須ではない。
治療
XLHの治療は活性型ビタミンD(カルシトリオールやアルファカルシドール)と経口リン製剤の併用療法が一般的であった。治療によって骨格の変形と成長障害は改善したが、完全ではない。成人では症状と骨石灰化を改善するが、腱付着部症の予防や治療はできない。
近年、FGF23受容体に結合し、その活性を阻害する遺伝子組み換えヒトIgG1モノクローナル抗体であるブロスマブが登場した。phase1のRCTでブロスマブの単回投与で血清リン、TmP/GFR、1,25OHビタミンDを増加させた。血清リン値のピークは8-15日目で50日以内にベースラインに戻った。続くphase1/2の非盲検、用量増加研究では、月1回のブロスマブ投与により効果が持続し、安全面も良好であった。長期の成績については現在も臨床研究が続けられている。
活性型ビタミンD製剤と経口リン製剤の治療は長期的に副作用を起こす可能性がある。高Ca尿症によって腎結石・腎石灰化・腎障害を起こしうる。リン製剤では下痢や腹痛を起こし、服薬コンプライアンスが低下しやすい。またリン製剤の長期投与によって二次性副甲状腺機能亢進症が起こり、時に三次性副甲状腺機能亢進症となり高Ca血症を起こすことがある。
腫瘍性骨軟化症
腫瘍性骨軟化症(tumor-induced osteomalacia; TIO)は1947年に初めて報告されたが、骨からくる病を起こす物質が産生され、その除去によって改善するという理論は1959年に提唱され、FGF23やそのリンを調節するホルモンとしての機能の発見にはそこから数十年かかった。500例以上が文献で報告され、診断時の平均年齢は45歳で幅広く、性差はない。
TIOは稀な傍腫瘍性症候群でありびまん性の骨痛、筋力低下、骨折を呈する。その原因は小型の間葉系腫瘍によるFGF23の異所性産生による。FGF23は骨細胞と骨芽細胞によって主に産生され、腎におけるリンの尿細管再吸収と1α水酸化酵素を抑制する。よってFGF23過剰では低リン血症を起こし、1,25OHビタミンDの産生は抑制される。
TIOは通常、間葉系腫瘍に起因し、病理学的にはphosphaturic mesenchymal tumor, mixed connective tissue variant(PMTMCT)と呼ばれる良性腫瘍に多い。稀に骨肉腫、巨細胞腫、グロムス腫瘍、肺小細胞癌、大腸癌などで起きる。これらの腫瘍は注目しないと見逃されるほど小さく、成長が遅く、局在の同定が難しい特徴がある。腫瘍の約半分は骨格にあり、残りは軟部組織にある。病理では核分裂活動が乏しい紡錘形や星形の細胞で、FGF23で染色される。
TIO患者は通常何年も診断されずに長期間進行性の障害を伴う症状を抱えていることが多い。TIO患者の多くは関節リウマチ、悪性腫瘍、さらには精神疾患などと誤診され、不適切な治療を受けている。TIOを疑った場合は空腹時の血清リン濃度の測定から始めるべきである。外来患者において低リン血症は一般的でないため、2.5mg/dL未満のリン濃度出会った場合に疑うべきである。ALPの上昇はそれをさらに裏付けする。ほぼ全ての低リン血症性くる病・骨軟化症で骨リモデリングが低下しているにも関わらずALPが上昇する理由はよくわかっていない。FGF23はほとんどの症例で不適切に高値を示す。家族歴や代謝性アシドーシスを伴う場合はTIOらしくない。画像所見はほかの骨軟化症と同様である。
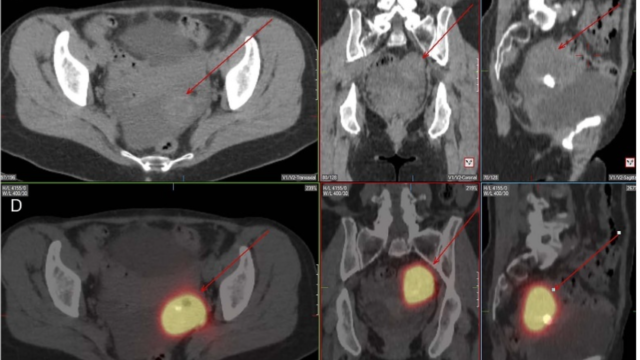
腫瘍の局在はTIO診療の難しい点である。ソマトスタチン受容体は間葉系腫瘍の多くで発現しているため、オクトレオチドスキャンで約50%の患者で局在が判明する。特に四肢や顔面骨病変で陽性になりやすい。FDG-PETは感度は高いが、偽陽性になりやすい。ガリウム-DOTATATE-PETは新しい画像モダリティで幅広く使用されるようになっている。FGF23の選択的静脈サンプリングも腫瘍の部位の同定に有用である。
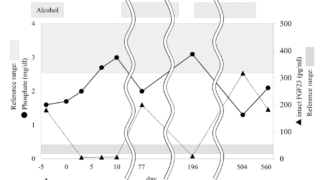
TIOの治療は腫瘍の切除が第一選択であり、治癒する。腫瘍再発を避けるために広範な外科手術が必要となる。血清リンとFGF23(半減期は45分程度)の正常化は24時間以内に得られるが、骨軟化症病変の治癒には数ヶ月かかる。まれに転移によって再発することがある。
腫瘍の局在が同定できなかったり、切除困難な部位の場合はビタミンDや経口リン製剤などの薬物治療を行う。
薬剤誘発性骨軟化症
薬剤誘発性くる病骨軟化症で現在最も多いのは核酸逆転写酵素阻害薬(NRTI)のテノホビル、アデホビルである。他の薬剤として抗てんかん薬、アルミニウムを含む制酸剤、窒素を含まないビスホスホネート、フッ化ナトリウムなどがあるが、これらは一般的ではない。
アデノシン類似体のNRTIであるテノホビルとアデホビルは、現在HIVやウイルス性肝炎の治療に広く使用されている。これらの薬剤使用中にファンコーニ症候群、腎不全、骨軟化症の発症が報告されている。ファンコーニ症候群は近位尿細管における障害であり、低リン血症・代謝性アシドーシス・尿糖・アミノ酸尿などを起こす。尿細管障害によるリン排泄、低リン血症はXLHやTIOと同様に低リン血症性くる病・骨軟化症を引き起こす。しかし、これらとは異なりFGF23濃度は正常であることが特徴である。NRTI開始からFanconi症候群の発症まで1-26ヶ月で、骨軟化症の発症率は0.5%とされている。プロテアーゼ阻害薬との併用はNRTIの細胞内濃度を高めるため、毒性が高まる。テノホビルによる腎障害の機序はよく分かっていないが、ミトコンドリア障害とヒト有機アニオントランスポーター1(OAT1)の変化によるとされている。早期に発見され薬剤を中止すると低P血症と腎機能障害はすぐに改善するが、骨軟化症を起こした場合はビタミンD製剤とリン製剤による治療が必要となる。
抗てんかん薬であるフェニトイン、プリミドン、フェノバルビタール、リファンピシンは肝臓においてビタミンDを非活性代謝産物に変換するCYP450を誘導し、利用可能な25OHビタミンDを減少させる。これによって生じるビタミンD欠乏が長期かつ重度の場合はくる病・骨軟化症を引き起こす。症状や所見は全て栄養性ビタミンD欠乏くる病・骨軟化症と同様である。治療は栄養性ビタミンD欠乏に用いる補充量のビタミンDとカルシウムで十分である。NRTIとは異なり薬剤の中止をする必要はないが、生涯にわたるビタミンD欠乏のフォローが必要となる。
イソニアジドとケトコナゾールは腎臓の1α水酸化酵素を阻害しビタミンD欠乏を起こすことがあるが、くる病・骨軟化症を起こした症例報告はない。
以前は透析液に水道水とアルミニウム含有リン結合剤を使用していたことに関連するビタミンD抵抗性骨軟化症が維持透析患者にみられた。アルミニウムは優先的に石灰化骨と非石灰化骨の境界に沈着し、骨基質の合成とその後の石灰化を解離させ、過剰な骨基質の蓄積を引き起こす。現在はそのような透析液や薬剤を使用しないのでアルミニウム誘発性骨軟化症はほとんど無くなった。類似の骨軟化症が、アルミニウム含有制酸剤であるスクラルファートが特にアルミニウム含有リン結合剤または止痢薬と併用された場合に報告されている。
鉄沈着による骨軟化症の病態はより複雑である。興味深いことに、アルミニウムと鉄は石灰化骨と類骨の境界で共局在し、一部の患者は鉄の点滴治療を受けることでFGF23関連の低リン血症性骨軟化症を起こす。
エチドロネートとフッ化ナトリウムによる薬剤誘発性骨軟化症は、高用量かつ長期間使用した場合に稀に報告されているが、現在承認されている第2世代の窒素含有ビスホスホネートによる骨軟化症の報告はない。
アルミニウム、鉄、エチドロネート、フッ化ナトリウムによる石灰化不全はビタミンD欠乏性やリン欠乏性骨軟化症の組織と比べると類骨の蓄積は同じだが、類骨の厚さは増加せず、むしろ薄くなることがある。このタイプの組織は非典型的骨軟化症(atypical osteomalacis; AOM)という。骨回転は非常に遅く、石灰化骨と類骨の間にアルミニウム染色が陽性となることで診断され、ビタミンD治療に反応しない。エチドロネートとフッ化ナトリウムによる骨軟化症では、類骨の蓄積がまだらで、非常に厚い類骨が骨表面や骨間質内にランダムに分泌し、局所性骨軟化症(focal osteomalacis; FOM)と呼ばれる。
薬剤性くる病・骨軟化症の原因
Fanconi症候群を起こす薬剤
NRTI:テノホビル、アデホビル、シドホビルなど
ビタミンD欠乏状態を起こす薬剤(CYP450誘導)
フェニトイン、フェノバルビタール、プリミドン、カルバマゼピン、バルプロ酸
骨石灰化障害を起こす
アルミニウム、フッ化物、鉄、エチドロネート
器質的な疾患で説明不能な筋力低下・骨痛・全身痛をみたときに骨軟化症を想起し、ALP上昇・低P血症がないか検査する。
原因としてビタミンD欠乏、腫瘍性骨軟化症、X連鎖性低リン血症くる病・骨軟化症が多い。
低リン血症時のFGF23>30pg/mLはFGF23関連低リン血症を示唆する。
〈参考文献〉
Williams Textbook of Endocrinology, 14th ed. 31 Rickets and Osteomalacia
くる病・骨軟化症の診断マニュアル