インスリノーマの次に多い内因性低血糖症の原因であり、高インスリン血症性低血糖症をみたときはインスリン抗体を提出する。
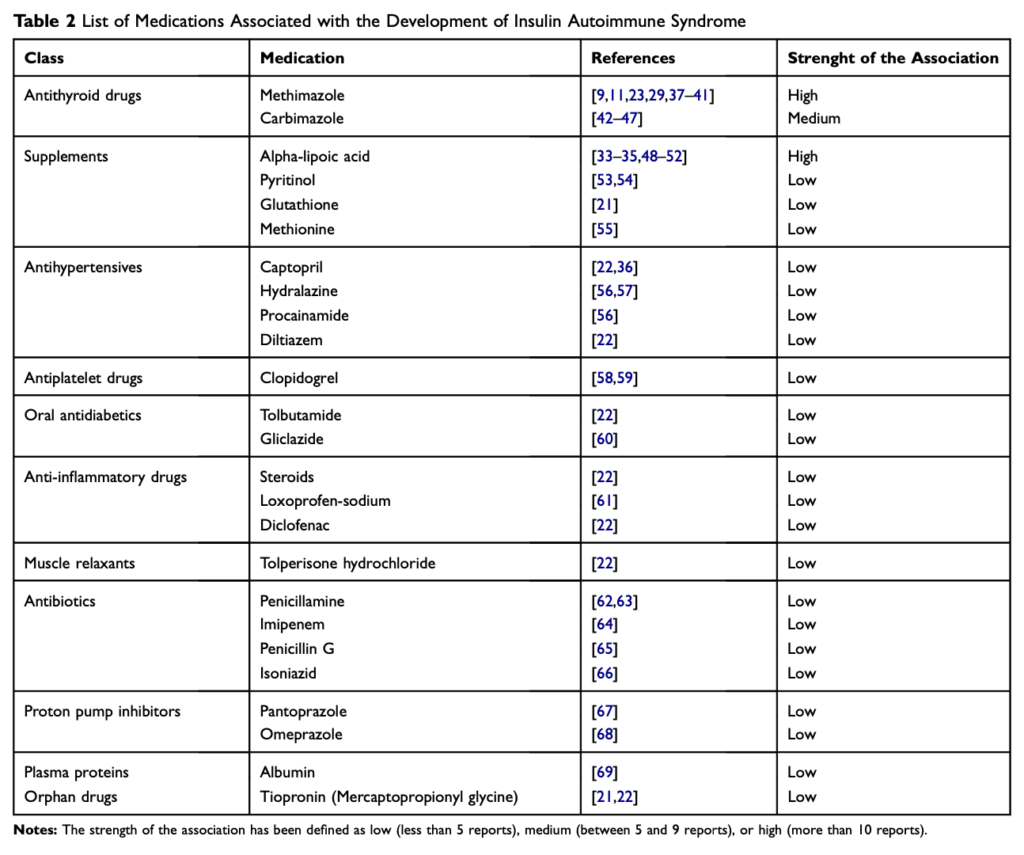
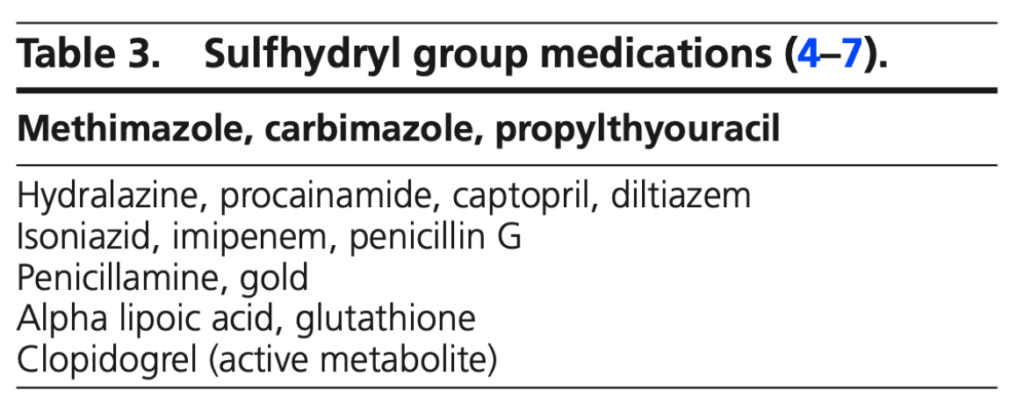
メチマゾールとαリポ酸が原因として有名であり、疑ったら薬剤の内服について確認する。
自然寛解が期待できる病態だが、必要に応じてステロイドやソマトスタチン製剤、ジアゾキシドなどの薬剤を使用する。
はじめに
インスリン自己免疫症候群(IAS; insulin autoimmune syndrome)は高インスリン性低血糖症を引き起こす疾患であり、インスリン製剤の使用歴がない患者にインスリン自己抗体(IAA)価の上昇を認めることで診断される。近年はインスリン製剤使用中の患者にみられるIAAにおいても血糖値の不安定が報告されている。1970年に平田幸正先生が初めて報告したことから「平田病」としても知られている。アジア人に多く、本邦からの報告が約9割と非常に多い。インスリノーマの次に多い、自発性低血糖症の原因である。2019年の本邦の報告では0.017/10万人の発症率であり非常に稀な疾患である。韓国からの報告では高インスリン性低血糖症の6%がIASであったとされる。性差はなく、女性では40代、男性では70代に多い(女性のほうが発症年齢が若いのは、バセドウ病の影響と考えられる)。小児では稀。
トリガー
薬剤やウイルス感染によって誘発されることがある。
なかでも薬剤性は40-50%を占めるため重要。
抗甲状腺薬のチアマゾール、痩せ薬のサプリメントのαリポ酸などSH基が付いた薬剤が原因として有名。インスリンのS-S基が切断されて、通常暴露されないインスリンのエピトープに対する抗原性が増すため。自己抗体が出現すると想定されている。クロピドグレルによるIASの報告もある。クロピドグレル自体はSH基を持たないが、代謝産物がSH基を持っている。一方でアルブミンのようなSH基を含まない薬剤でも報告されている。
ウイルス感染では麻疹、ムンプス、風疹、水痘帯状疱疹、コクサッキーB、C型肝炎などが発症のトリガーとなる。白色人種において多発性骨髄腫やMGUSとの関連が報告されている。
遺伝的背景
1992年に本邦からHLA-DR4との強い相関が報告された(48/50)。OR39.6。DRB1*0406が42/48、OR56.6と最も関連が強く。DRB1*0403は5/48,OR1.6、DRB1*0407は1/48,OR1.1と関連が少ない。白色人種の場合はHLA-DRB1*0403が多く、DRB1*0406は少ない。
本邦のバセドウ病患者で抗甲状腺薬によるIASが多いのはDRB1*0406を持っていることが多いためと考えられる。アジアでαリポ酸によるIASを起こした20名は全員DRB1*0406を持っていた。
よってインスリン自己免疫症候群はDRB1*0406を持つ患者がメチマゾールやαリポ酸などのトリガーに曝露されることによって発症する。
機序
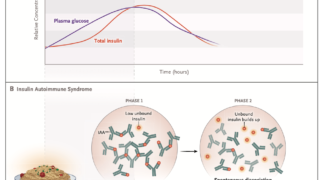
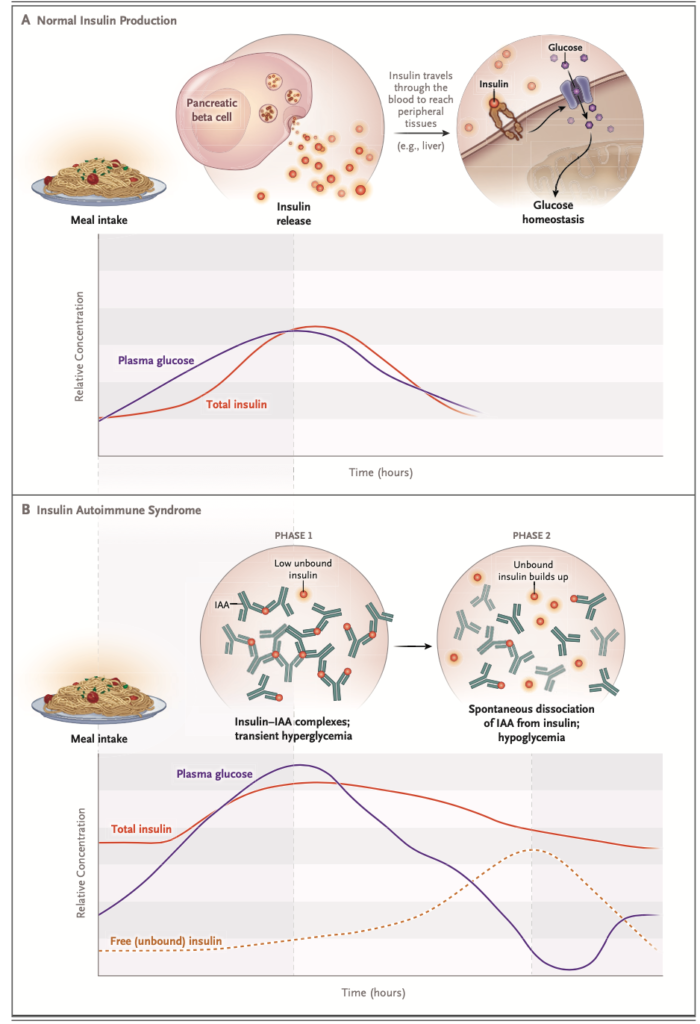
インスリン自己抗体は、その高い結合能により、数分子のインスリンと結合し、大きな抗原抗体複合体を形成することが可能。一方でインスリンに対する親和性が低いため、自然解離速度が大きく、血中のインスリン濃度を不適切に上昇させ低血糖発作を引き起こす。この高い結合能と低い親和性は、IASを誘発するインスリン自己抗体の特異的な特徴。
インスリン製剤を使用している患者にもインスリン自己抗体を認める事が多いが、低血糖や高血糖を起こすことはほとんどない。これはインスリン製剤使用によって誘発されたインスリン自己抗体は低い結合能と高い親和性を特徴とするためである。稀にインスリン製剤使用中の患者に高い結合能と低い親和性を有するインスリン自己抗体がみられることがあり、これは血糖の不安定性につながる。
臨床症状
IASによる低血糖は上記の機序から考えられるように、ほとんど食後に起こる。しかし空腹時に低血糖を起こす症例もいる。
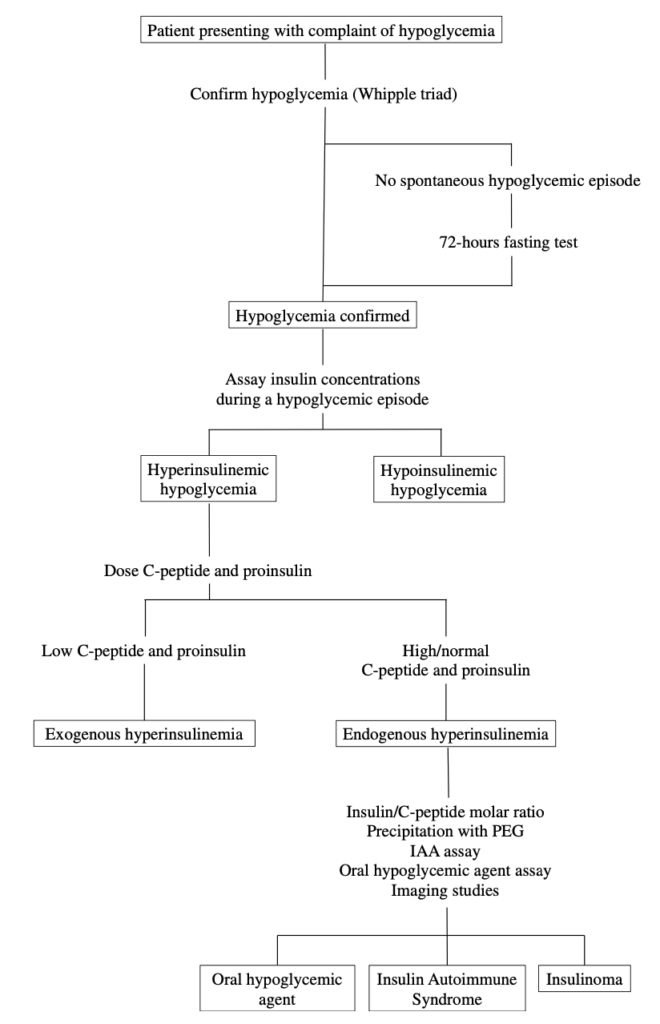
検査
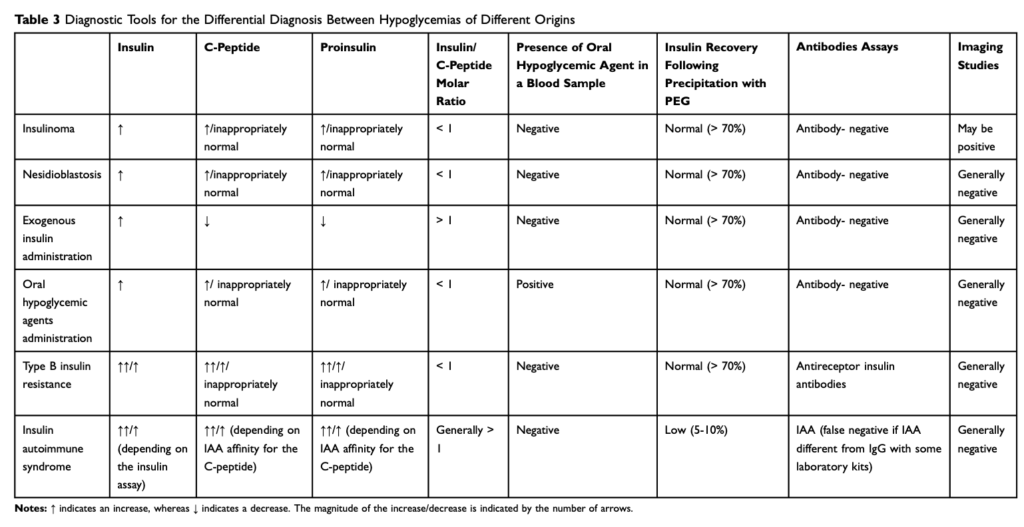
通常、インスリン自己免疫症候群の患者は、しばしば1000pmol/Lを超える極めて高いインスリン濃度を示すが、これは他の高インスリン性低血糖症では稀な所見である。
インスリン・Cペプチド比
インスリン自己免疫症候群ではインスリン/Cペプチド > 1が有用とされる(単位は両者ともpmol/Lに揃える)。インスリンとCペプチドは膵β細胞で同時に産生されるが、インスリンの半減期が5-10分、Cペプチドの半減期が30-35分のため、通常インスリン/Cペプチドは1以下となる。インスリン自己免疫症候群ではインスリンがインスリン抗体と結合するため半減期が数時間に延長し、インスリン/Cペプチドは1以上となる。ただインスリン抗体がCペプチドに結合したり、Cペプチドの測定に影響を及ぼすことがあるので、この指標は必ずしも信用できるわけではない。ほかにインスリン/Cペプチド > 1となる原因に外因性のインスリン投与がある。
インスリン自己抗体
自己抗体(IAA)はIgGがほとんどだが、IgAやIgMの報告も稀にある。市販のIAAの検査はIgGのみを対象にしていることが多いので、偽陰性がありえる。疑わしい場合はPEG法による検査を行う。
インスリンアナログはヒトインスリンと比較して免疫原性は低いが、外因性のインスリン投与はIAAを誘発することがある。これらのIAAは弱く、インスリンを中止したり他の製剤に切り替えた場合に消失する傾向がある。稀に外因性インスリンによるIAAがIASのように遊離インスリンと結合し、インスリンクリアランスを遅延させ、食後の低血糖を起こしたり、インスリン抵抗性を引き起こすことがある。よって外因性インスリンを投与している糖尿病患者に原因不明な血糖の不安定性を認めた場合はIAAの存在と影響を考慮する必要がある。
インスリン自己抗体はインスリン自己免疫症候群だけでなく、1型糖尿病の自己抗体でもある。小児の1型糖尿病の48% 、成人の1型糖尿病の3.8%で陽性となり、小児に認められることが多い。
治療
IASは基本的に自然軽快する疾患である。1970年から1992年にかけてIASと診断された197名の患者を対象とした再調査では、IAS患者の約82%が自然寛解している。このコホートにおける低血糖エピソードの持続期間は1~3ヵ月であった。原因となった薬剤中止が望ましいが、実際に薬剤の中止が経過に与える影響についての研究はないので、その意義は不明である。食事療法として頻回な食事と少量の炭水化物が推奨される。重症患者では持続血糖モニタリングも考慮する。薬物治療としてはグルココルチコイド、ソマトスタチン製剤、ジアゾキシド、αグルコシダーゼ阻害薬、アザチオプリン、リツキシマブなどの使用の報告がある。症例数が少ないので治療の適応や方法に関するエビデンスはない。グルココルチコイドは血糖値上昇とIAAのtiter減少の両方に効果がある。αグルコシダーゼ阻害薬は、食後の血糖値とインスリンの上昇を抑えるために使用することができるが、下痢や腹部膨満など消化器症状の副作用があるため忍容性は低い。
寛解後の再発率は低い。197例の日本人を対象とした再調査の報告では、再発は9例のみであり5%未満だった。
インスリノーマの次に多い内因性低血糖症の原因であり、高インスリン血症性低血糖症をみたときはインスリン抗体を提出する。
メチマゾールとαリポ酸が原因として有名であり、疑ったら薬剤の内服について確認する。
自然寛解が期待できる病態だが、必要に応じてステロイドやソマトスタチン製剤、ジアゾキシドなどの薬剤を使用する。
〈参考文献〉
Insulin autoimmune syndrome: from diagnosis to clinical management. Ann Transl Med. 2018;6:335.PMID: 30306074.
Insulin Autoimmune Syndrome (Hirata Disease): A Comprehensive Review Fifty Years After Its First Description. Diabetes Metab Syndr Obes. 2020;13:963-978. PMID: 32308449.
The After-Dinner Dip. N Engl J Med 2022;386:2130-6.