・寒冷凝集素症は原発性の寒冷凝集素症(CAD)、二次性の寒冷凝集素症候群(CAS)に分けられる。
・CADの原因はPrimary CAD-associated lymphoproliferative disorderであり、モノクローナルな寒冷凝集素・IgM κを産生し、特徴的な骨髄所見を示す。
・治療は寒冷曝露の回避、リツキシマブなどのB細胞指向型治療、スチムリマブなどの補体阻害療法であるが、保険適応はスチムリマブのみである。軽症例は寒冷曝露の回避など非薬物療法のみで経過をみることができる。
はじめに
寒冷凝集素症の患者を外来管理することになったので、勉強したことをまとめます。
寒冷凝集素症は自己免疫性溶血性貧血(AIHA)の1種であり、寒冷凝集素(低温で赤血球抗原に結合するIgM自己抗体)が身体の冷たい部分で赤血球凝集と溶血性貧血を起こす。
広義の寒冷凝集素症(Cold Agglutinin Disease, CAD)のうち、原疾患を持たないものは原発性(特発性)CAD、なんらかの疾患に伴うものは続発性CADとされていたが、近年原発性CADは独立したリンパ増殖性疾患(lymphoproliferative disease: LPD)であることが明らかとなり、原発性のものをCAD、続発性のものをCold aggulutinin syndrome (CAS)と呼ぶことになっている。
病態生理
赤血球抗原
赤血球表面には様々な抗原エピトープがあるが、ほとんどの寒冷凝集素は”I”または”i”を標的とする。”i”は胎児型赤血球の主要な構造である。幼児期にiはIに徐々に変換される。ほとんどの小児は2歳までにI陽性となる。iとIの役割は不明。Iは健常人の99%の赤血球に認める。iを認めるのは1%未満。マイコプラズマ肺炎ではI抗原、伝染性単核球症ではi抗原に対する寒冷凝集素と関連あり。しかし、抗原の違いで背景疾患の鑑別はできない。
寒冷凝集素
CADでは寒冷凝集素はλではなくκが多い。ノルウェイの大規模コホートでは、94%の寒冷凝集素の軽鎖はκであった。CADではほとんどが抗I抗体。Titerとして64倍以上が有意な寒冷凝集素を考えられる。最も結合しやすい温度は3-4℃(冷蔵庫の温度)だが、病的な寒冷凝集素では体表温度が28-30℃かそれ以上でも結合する。結合温度閾値が低い抗体ではin vitroでは凝集を起こすが、臨床症状を呈することは少ない。寒冷凝集素はモノクローナルでもポリクローナルもありうる。モノクローナルの場合はリンパ増殖性疾患と関連があり、ポリクローナルよりも病原性が高い。ほとんどの原発性CADは低グレードのリンパ増殖性疾患から生じていると考えられており、ほとんどがモノクローナルである。悪性リンパ腫に関連した二次性CASではモノクローナルだが、ウイルス感染に伴うものはポリクローナルである。治療としてモノクローナルの場合はB細胞と標的とした治療が必要となるが、感染に関連したポリクローナルでは自然軽快する例がほとんどである。
Primary CAD-associated lymphoproliferative disorder
背景に悪性疾患がない場合でも、原発性CADのほとんどはモノクローナルな寒冷凝集素を産生しており、リンパ増殖性疾患によるモノクローナルな産生が示唆される。”CAD-associated lymphoproliferative disorder“はこのような状態を表す言葉として提案された。2022年にWHOはCADをリンパ系悪性腫瘍と定義した。
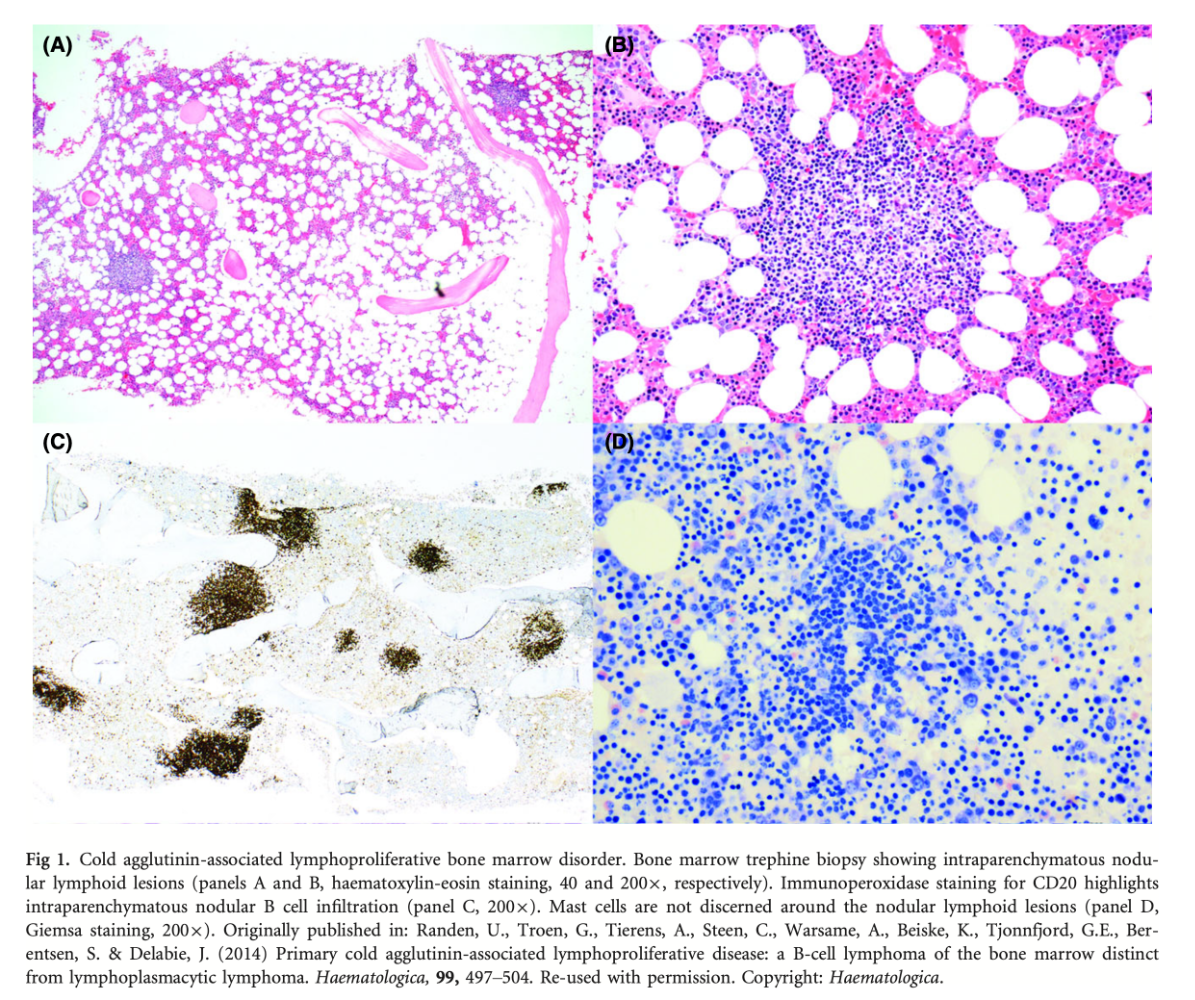
骨髄検査では結節性のB細胞集簇のリンパ球浸潤で54例中40例(74%)に認められた。残りの14例では散在するB細胞が観察された。成熟した形質細胞は、集簇の周囲および骨髄全体に散在して観察されたが、形質細胞の数は一般的に増加していなかった(有核細胞の2-10%)。免疫フェノタイピングでは、リンパ球は主にIgMとκ軽鎖を発現するB細胞であり、形質細胞はIgMとκ軽鎖を発現していた。主な免疫フェノタイプは、CD19、CD20、CD22、CD79b、およびFMC7陽性で、CD23は陰性、CD5は半数未満の症例で認められた。リンパ球集簇を認めなかった14例では、血液または骨髄のフローサイトメトリーで、同様の特性を有するモノクローナルなB細胞が認められた。免疫フェノタイプは、節外性・節性濾胞辺縁帯B細胞リンパ腫と似ているが、節外性病変があるCAD患者はいなかった。
マクログロブリン血症患者の骨髄所見であるLPLに特徴的な所見は認めない。マスト細胞の増加、paratrabecular growth、線維化など。LPLに特徴的なMYD88 L265P変異も検査した17例全例陰性であった。
アグレッシブな悪性リンパ腫に転位する可能性はかなり低く、10年間で3-4%程度とされる。
溶血の機序
CADにおける溶血は主に血管外溶血であり、補体によって媒介される。
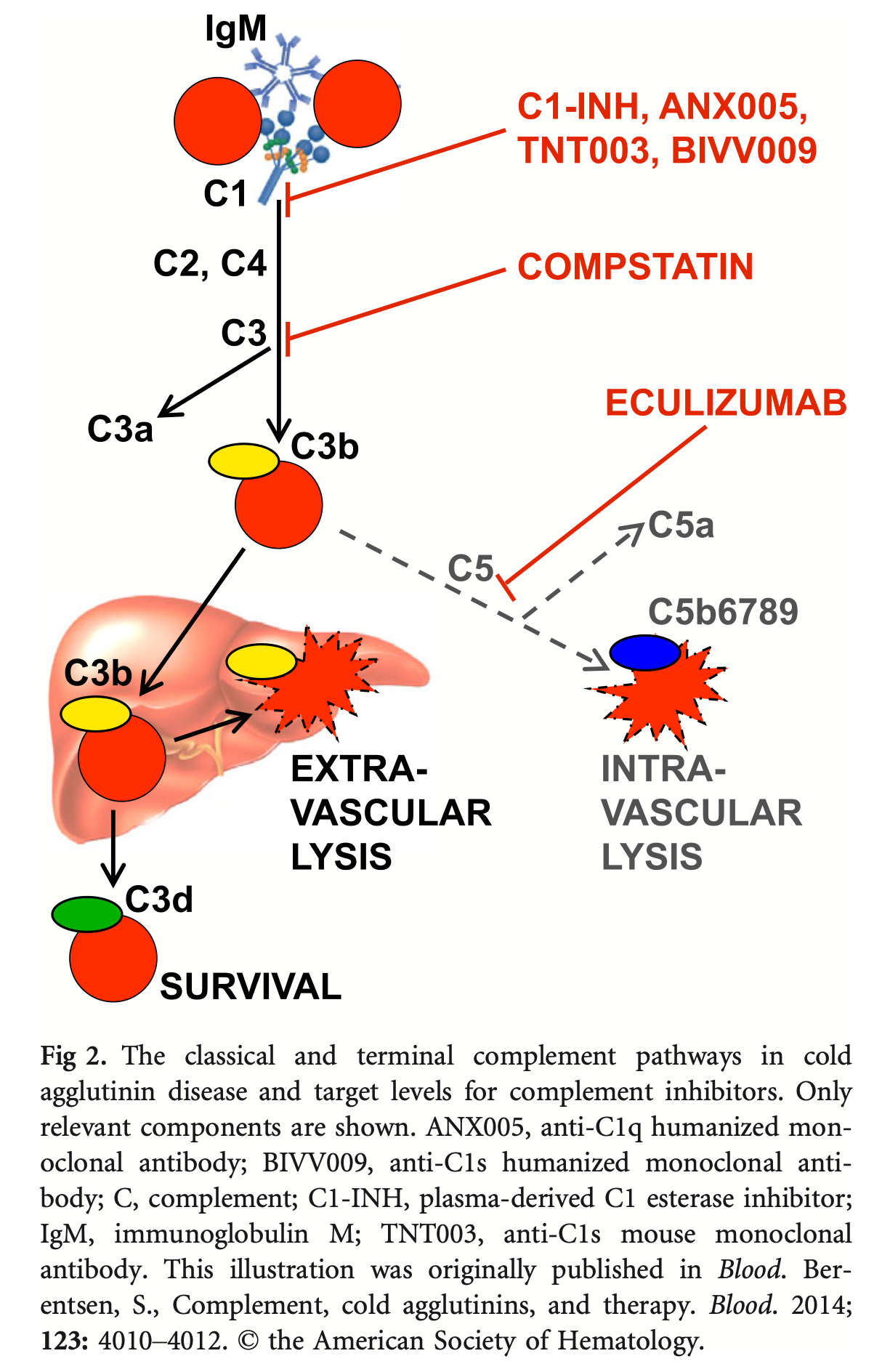
1. 寒冷凝集素の結合: 血液が体の末梢部分で冷えると、IgM寒冷凝集素が赤血球表面の抗原(通常は”I”または”i”抗原)に結合する。
2. 補体経路の活性化: 結合したIgMは、C1、C4、C2などの古典的補体経路の成分を活性化する。
3. C3bの生成: C1エステラーゼはC4とC2を活性化し、C3bへのC3の切断を引き起こすC3変換酵素を生成する。
4. 貪食: C3bで覆われた赤血球は、主に肝臓のクッパー細胞によって細網内皮系で貪食される(血管外溶血)。残存する赤血球では、温まるとIgMは解離するが、C3bは結合したままであり、C3dに切断され、直接抗グロブリンテスト(DAT)で検出可能となる。
通常、赤血球表面の補体阻害因子(CD55、CD59など)は古典的補体経路が終末経路を活性化するのを防ぐため、血管内溶血は通常起こらない。しかし、溶血が特に活発な場合(感染、手術、炎症など)には、血管内溶血の要素が生じる可能性があり、その際にはヘモグロビン尿を伴うことがある。
疫学
CADはまれな疾患であり、北欧諸国からの後方視的レビューによると、発生率は年間約1〜1.8人/100万人、有病率は約13〜16人/100万人と推定されている。ノルウェーと北イタリアのロンバルディア地方を含む研究では、ノルウェーの有病率が約20人/100万人、ロンバルディア地方が約5人/100万人と、寒冷地で有病率が4倍高いことが示唆されており、気候がCADの診断頻度に顕著な関連を持つことが示されている。
患者の平均年齢は、発症時で67歳、診断時で68歳、男女比は0.56(男性がやや少ない)。
二次性であるCASの頻度はケースシリーズからの推測による。デンマークの496例のマイコプラズマ感染症において、407例 82%にin vitroで寒冷凝集素を認めたが、臨床症状や溶血との関連はなく、ほとんどの寒冷凝集素は臨床的にsilentであると考えられた。217例のマクログロブリン血症患者において、5%が寒冷凝集素陽性だったが、溶血を伴ったのは1.5%のみであった。
関連する疾患
若年者では感染症や自己免疫性疾患が背景にあることが多く、高齢者では悪性リンパ腫やマクログロブリン血症が背景にある可能性がある。
感染症
マイコプラズマ、EBウイルスが有名。ケースレポートレベルではHIV、風疹、インフルエンザ、COVID-19、VZVにおいても寒冷凝集素の報告あり。
すべての患者が臨床的に重要な溶血を起こすわけではない。起こす場合でも通常感染から約2週間後に起こり、感染の改善ともに減少し、通常は2-3ヶ月で消える。
自己免疫疾患
SLEや関節リウマチの患者で寒冷凝集素が認められることがある。
リンパ増殖性疾患
2020年の232例の原発性CADのシリーズでは、CAD-associatedリンパ増殖性疾患が27%、LPL(マクログロブリン血症でみられるリンパ腫)が14%、濾胞辺縁帯リンパ腫 4%、小リンパ球リンパ腫 4%、分類不能なリンパ増殖もしくは反応性リンパが18%に認められた。残りの31%は骨髄増殖性疾患はないと判断された。しかし、その後CADの病理に長けた病理医が判定したところCAD関連のリンパ増殖性疾患が76%と判断され、クローナルなリンパ増殖性疾患ではないとされたのは13%のみであった。
2013年の89例のCAD(年齢中央値は65歳)では、リンパ増殖性疾患は78%で、MGUS47%、非ホジキンB細胞リンパ腫9%、分類不能なリンパ増殖性疾患9%、CLL4%であった。
臨床所見
CAD発症時の平均年齢は60歳代後半で、30-90歳代と幅広い。溶血や寒冷凝集素症の診断は冬季に多いが、診断後は臨床所見や血液異常は通年であることが多い。致死的な溶血は心肺バイパス術のような低体温を伴う心手術での報告がある。最大規模である232例の報告では、貧血(平均Hb 9.5g/dL)が90%、溶血所見 (LDH・ビリルビン高値、ハプトグロビン低値)が90%、寒冷誘発症状が52%に認められた。レイノー現象や潰瘍は一部の少数の患者にみられた。倦怠感はよく認められる症状だが、貧血や補体活性化に伴う症状と考えられるが詳細な機序は不明。輸血は診断時やフォロー時の38-47%に行われた。フォローアップ中に3.4%がDLBCLに進展した。
寒冷誘発症状
CADにおいて先端部の寒冷誘発症状は極めて一般的で、スカンジナビアのような寒冷地域に住むCAD患者の90%に認められる。
指趾、鼻、耳のチアノーゼ、Livido reticularis、レイノー現象、重症例では皮膚潰瘍・壊死、冷たい食物や飲み物による疼痛や不快感。
これらの症状は赤血球凝集に起因し、補体には依存しない。
溶血性貧血
貧血を伴わない代償性の溶血から輸血を要する重度の溶血性貧血までさまざま。
溶血は寒冷だけでなく、感染症によっても増悪しうる。感冒、肺炎、大腿骨骨折など。15例の慢性CAD患者では5例が発熱時に溶血悪化があった。
232例のCAD患者ではHb<8g/dLは25-30%だった。平均は9-10g/dL。
血栓症:
232例中30例(12.9%)の患者で合計38件の血栓症が発生し、うち14件が静脈性血栓症(VTE)であった。VTEのうち8例(57%)がPEを合併していた。動脈性塞栓のうち12例が脳梗塞(50%)、10例が心筋梗塞(42%)、2例が末梢塞栓を起こした。血栓症の合併は貧血の重症度とは関連なかった(Hb<8g/dL vs Hb≥8g/dL)。
検査
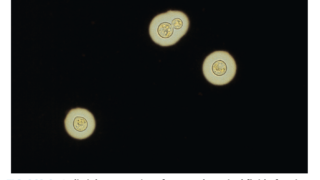
血液検査:貧血、MCVは様々、赤血球凝集、網状赤血球上昇、溶血所見、補体低下(C3、時にC4も)。IgM κのM蛋白陽性。
クームス試験:直接クームス試験でC3d陽性、免疫グロブリン陰性。
寒冷凝集素
Titer:抗体価は抗体の強さを反映する。赤血球凝集を起こす濃度を希釈しながら判定する。診断に必要なのは64倍以上だが、大抵は512倍以上で、多くは2048倍。
温度:抗体が抗原に結合する最も高い温度。臨床的に重要な寒冷凝集素の温度は28-30℃を超える。この温度は抗体価よりも臨床所見に対して重要だが測定が難しい。診断時には行うが、フォローアップには使わないことが多い。温度を検査するときは検体を凝固し血清を除去するまで37-40℃に保つ必要がある。
背景疾患の評価
感染症:発熱や呼吸器症状を伴う場合、罹病期間が短い場合は精査する。小児や若年者では伝染性単核球の精査をする。非定型肺炎では特にマイコプラズマを。
自己免疫疾患:関節痛・関節炎、皮疹、血球減少を伴う場合は特に精査が必要。SLEや症状に応じた精査を。
リンパ増殖性疾患・悪性リンパ腫:体重減少、リンパ節腫瘍、肝脾腫、リンパ球数上昇、血球減少などがある場合は特に。高齢者で感染や自己免疫疾患が背景にない場合。
診断
AIHAを認めた場合、凝集によりMCVが偽性高値を示している溶血、二次性CASを疑うような症例では精査を行う。
CADの診断は以下の3つの特徴をもって行うことが多い。
①溶血所見
網状赤血球数上昇、高LDH、高間接ビリルビン、低ハプトグロビンなど
②C3dの直接クームス試験陽性
通常は免疫グロブリンに対しては陰性だが、一部の患者ではC3d+弱IgGのこともある
③4℃における寒冷凝集素抗体価が64倍以上
治療
すべてのCAD患者が治療を必要とするわけではない。症状のない患者には治療効果は示されていない。症候性貧血、著しい疲労、または煩わしい寒冷誘発性循環器症状がある場合に治療が考慮される。治療は症状を最小限に抑え、許容できるヘモグロビン値を維持し、必要であれば基礎疾患に対処することを目的とする。
1. 非薬理学的管理
• 寒冷回避: 寒冷環境、冷たい水、冷たい液体の摂取を避けることが推奨される。入院中や手術時には特に重要であり、加温された輸液や輸血、加温ブランケットの使用が推奨される。
• 輸血: 適応があれば安全に実施可能である。ただし、輸血用血液や輸液は適切に加温し、患者の体温を保つ必要がある。
• 血漿交換: 重症溶血の緊急時には、一時的な措置として血漿交換がIgM抗体の除去に有効であるとされる。
2. 薬理学的治療
ステロイドや脾臓摘出術はCAD患者の大多数には効果がないとされている。これらは温式AIHAとは対照的である。本邦で保険適応となっている治療は抗C1s抗体であるスチムリマブ(®エジャイモ)のみである。
B細胞指向型治療
CADの原因となるモノクローナル寒冷凝集素を産生するB細胞クローンを標的とする。
本邦では保険適応ではない。
• リツキシマブ単剤療法: 奏効率は約50%であったが、完全奏効(CR)はまれで、奏効期間中央値は11〜12ヶ月と比較的短かった。再発患者への再治療も効果が期待できる。
• リツキシマブ+ベンタムスチン: CADの治療において高い奏効率と長期的な奏効期間が示されている、推奨される治療法である。45人の患者を対象とした研究では、78%が奏効し、53%がCRを達成した。奏効期間中央値は88ヶ月以上で達成されず、5年持続奏効率は77%と推定された。晩期発現型悪性腫瘍のリスクも低い傾向にある。
• リツキシマブ+フルダラビン: 奏効率は高いものの、骨髄抑制や感染症などの短期的・長期的な毒性がリツキシマブ+ベンタムスチンよりも高い傾向があるため、より慎重な考慮が必要とされる。
• ボルテゾミブ: リツキシマブを含むレジメンが無効または禁忌の場合に選択肢となるプロテアソーム阻害剤である。
• ダラツムマブ: 難治性のCAD患者で有望な結果が報告されており、他の化学免疫療法に抵抗性を示す選択された患者において、三次またはそれ以降の治療法として考慮され得る。
• ブルトン型チロシンキナーゼ(BTK)阻害剤: ibrutinibなどのBTK阻害剤は、骨髄中のCAD関連LPDのB細胞で報告されている遺伝子変異KMT2DとCARD11から理論的に考えられるが、体系的な研究は不足している。
補体阻害療法
溶血の主な原因である古典的補体経路の活性化を標的とする。これらの治療法は、輸血の必要性を減らし、貧血と疲労を改善する。ただし、寒冷凝集素を産生する細胞を排除するものではなく、赤血球凝集による寒冷誘発性症状を改善する効果は期待できない。B細胞指向型治療が効果的でない、あるいは禁忌である場合に考慮されることが多い。
古典的補体経路を阻害するため、髄膜炎菌等の莢膜形成細菌による感染症が発症する可能性があることから、原則、投与開始の少なくとも2週間前までに髄膜炎菌および肺炎球菌に対するワクチンを接種する必要がある。
スチムリマブ(Sutimlimab、®エジャイモ、抗C1s抗体): 溶血性貧血および疲労を改善し、輸血回避に有効であることが示されている。ただし、寒冷誘発性循環器症状には効果がない。
• ペグセタコプラン(Pegcetacoplan、抗C3抗体): 溶血性貧血および疲労を改善する効果が示されているが、臨床試験が早期終了したため、さらなるデータが待たれる。
• リリプルバート(Riliprubart、治験中の抗C1s抗体): 治験段階のC1s阻害剤で、ヘモグロビンレベルの改善と溶血マーカーの減少が報告されているが、第3相試験は開始されていない。
予後
CAD患者の予後は年齢調整後の健常人とあまり変わらないかやや短い程度。大規模シリーズでは診断(平均68歳)からの平均生存期間は16年間で、5年生存率は83%と推定されている。
・寒冷凝集素症は原発性の寒冷凝集素症(CAD)、二次性の寒冷凝集素症候群(CAS)に分けられる。
・CADの原因はPrimary CAD-associated lymphoproliferative disorderであり、モノクローナルな寒冷凝集素・IgM κを産生し、特徴的な骨髄所見を示す。
・治療は寒冷曝露の回避、リツキシマブなどのB細胞指向型治療、スチムリマブなどの補体阻害療法であるが、保険適応はスチムリマブのみである。軽症例は寒冷曝露の回避など非薬物療法のみで経過をみることができる。
〈参考文献〉
UpToDate “Cold agglutinin disease” 2025.7.27閲覧
How I manage patients with cold agglutinin disease. Br J Haematol. 2018 May;181(3):320-330.
Cold agglutinin disease revisited: a multinational, observational study of 232 patients. Blood. 2020 Jul 23;136(4):480-488.