ネフローゼ症候群・肝硬変・低栄養が否定的な低アルブミン血症(浮腫、胸腹水、心嚢水)をみたときに疑う。
原因はびらん性胃腸障害、非びらん性胃腸障害、リンパ管圧の上昇の3つに分ける。
診断にはα1-アンチトリプシンクリアランス、アルブミンシンチグラフィを用いる。
原因不明の浮腫・胸腹水・低アルブミン血症の精査目的に入院された方が、便中α1アンチトリプシン・アルブミンシンチグラフィで蛋白漏出性胃腸症の診断となったので勉強。
概論
蛋白漏出性胃腸症(PLE)は、血清蛋白が消化管に喪失し低蛋白血症となり、浮腫・腹水・胸水・心嚢水、栄養失調を起こす稀な疾患。有病率については不明。
健常者では腸管粘膜からの喪失は血中蛋白は1-2%、アルブミンは10%未満程度である。
蛋白漏出性胃腸症ではアルブミンの60%程度が腸管から喪失するとされる。
臨床では低蛋白・低アルブミン血症の患者の鑑別において蛋白尿・ネフローゼ症候群(尿からの喪失)、肝硬変による蛋白合成障害、摂取不良・低栄養など他の原因が否定されたときに蛋白漏出性胃腸症(腸管からの喪失)を疑うことが重要。
原因
原因はびらん性胃腸障害、非びらん性胃腸障害、リンパ管圧の上昇(中心静脈圧の上昇、腸間膜リンパ管閉塞)の3つに分けられる。60種類以上の原因がある。
リンパ管圧の上昇(中心静脈圧の上昇・腸間膜リンパ管閉塞)
原発性腸管リンパ管拡張症(Waldmann病)
収縮性心膜炎、先天性心疾患、Fontan術後、うっ血性心不全(稀)
門脈圧亢進症(稀)・Budd-Chiari症候群、腸間膜静脈血栓症、後腹膜線維症、腸間膜結核・サルコイドーシス、腸間膜リンパ節またはリンパ管に関わる悪性腫瘍、偽嚢胞を伴う慢性膵炎、CD55欠損症など
非びらん性胃腸障害
メネトリエ病、H. pylori感染症、サイトメガロウイルス感染症、好酸球性胃腸症、顕微鏡的大腸炎、小腸内細菌異常増殖症、セリアック病、SLE、Sjögren症候群、ウィップル病、寄生虫感染
びらん性胃腸障害
潰瘍性大腸炎・クローン病、腸管悪性腫瘍(リンパ腫、カポジ肉腫)、NSAIDs、偽膜性腸炎、小腸リンパ腫、サルコイドーシス、急性GVHD、アミロイドーシス、ベーチェット病など

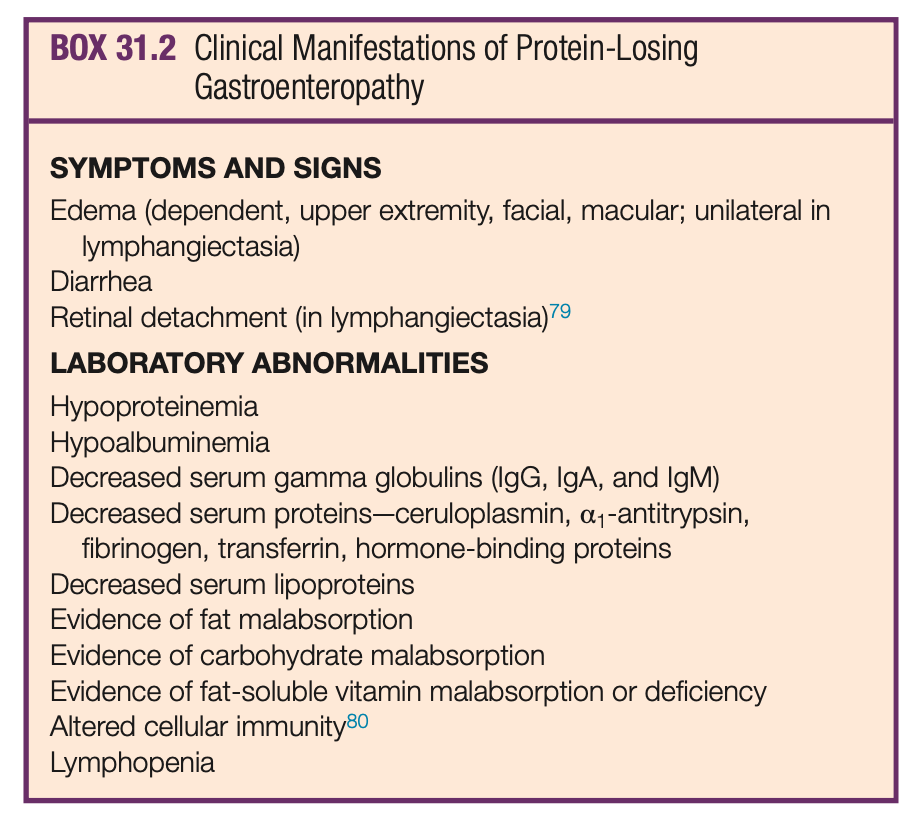
臨床所見
臨床症状は浮腫がメインとなる。下痢などの消化器症状はしばしば認めない。
蛋白漏出の影響を最も受けるのは半減期が長いアルブミン(17.3日、1日に約8.5%が交換される)、免疫グロブリン(IgG、IgA、IgM)、セルロプラスミン、リポ蛋白、トランスフェリン、α1アンチトリプシン(A1AT)などである。
肝臓での蛋白合成は正常もしくは代償的にわずかに亢進しており、ターンオーバーの早いプレアルブミン、IgE、インスリンなどの蛋白が正常もしくは増加する。
よって主な血液検査所見はアルブミン・総蛋白・ガンマグロブリン(IgG、IgA、IgM)・フェブリノーゲン・トランスフェリン・セルロプラスミン・α1アンチトリプシンの低下。
古典的なリンパ圧上昇状態(原発性リンパ管拡張症、収縮性心膜炎、フォンタン手術)の特徴的な所見は、リンパ球減少症とCD4陽性T細胞の劇的な減少(正常値の約10%)を認める。
小腸粘膜障害(例えばセリアック病、先天性腸管リンパ管拡張症)の場合、脂肪吸収不良とそれに伴う脂肪便や脂溶性ビタミンの欠乏が起こることがある。
診断
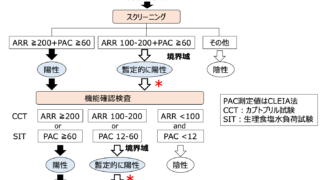
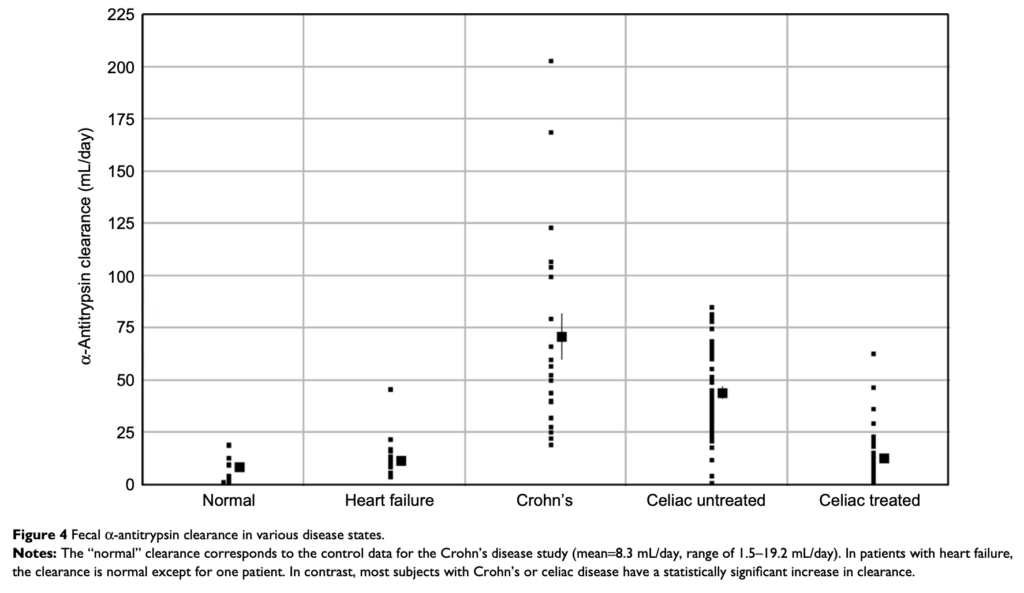
α-1アンチトリプシンクリアランス
診断は、α-1アンチトリプシンクリアランスを用いることが最も一般的。
α-1アンチトリプシン(A1AT)は肝臓で合成されアルブミンに近い分子量を持つタンパク質。腸管で分泌・吸収・分解されないまま糞便中に排泄される。
A1ATクリアランスの計算には、血液検査で血漿A1ATの測定と、24時間の便採取を行い便量と便中A1AT量を測定することが必要となる。
α1‐AT plasma clearance(mL/day)
= ([Daily stool volume] × [Stool α1‐AT])/Serum α1‐AT
健常者:平均は8 mL/day程度
下痢がない場合:20~24 mL/day以上で異常
下痢がある場合:56 mL/day以上で異常
偽陽性:乳児、腸管出血
偽陰性:胃からの蛋白漏出(A1ATはpH<3.0で分解される、酸抑制療法で回避できうる)
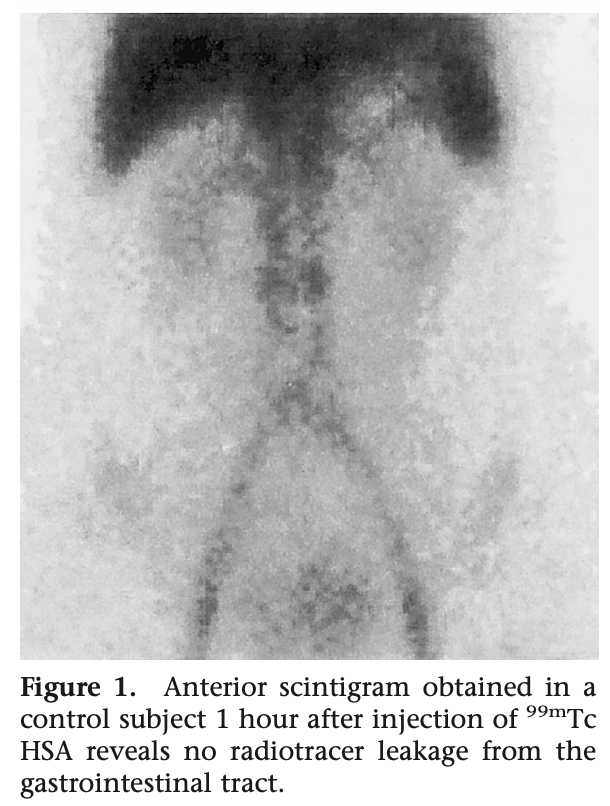
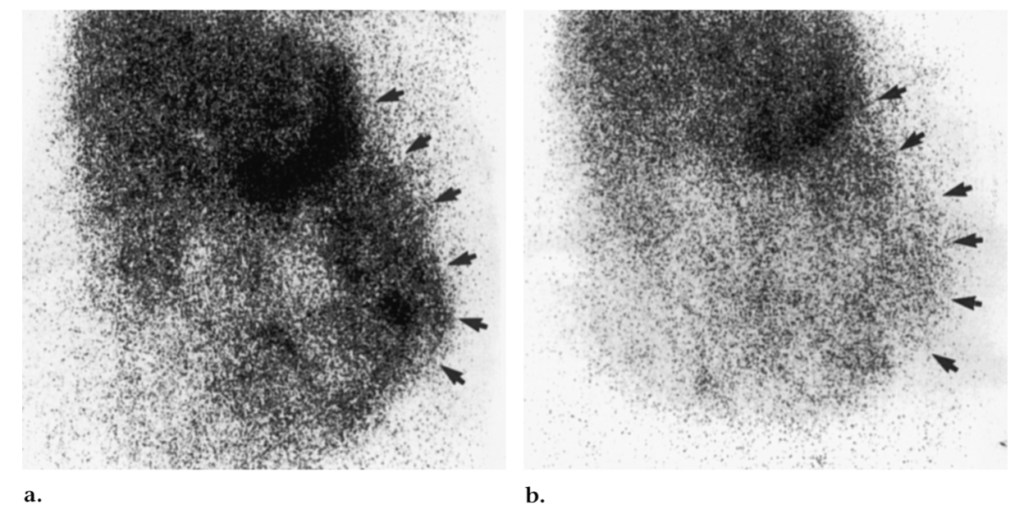
アルブミンシンチグラフィ
テクネシウム-99m標識アルブミン(99mTc-labeled Albumin)を用いたシンチグラフィによる腸管内蛋白質損失の記録は、診断だけでなく治療効果のモニタリングにも有用であることが示されている。
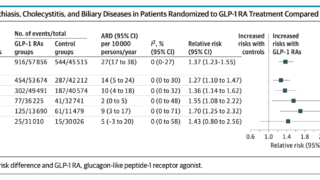
メタアナリシスの結果、感度87%(81-92%)、特異度62%(51-72%)と報告されている。
便中α-1アンチトリプシンクリアランスでは胃腸のどこから漏出が起きているか不明だが、シンチグラフィは漏出部位の特定もできることがメリットである。
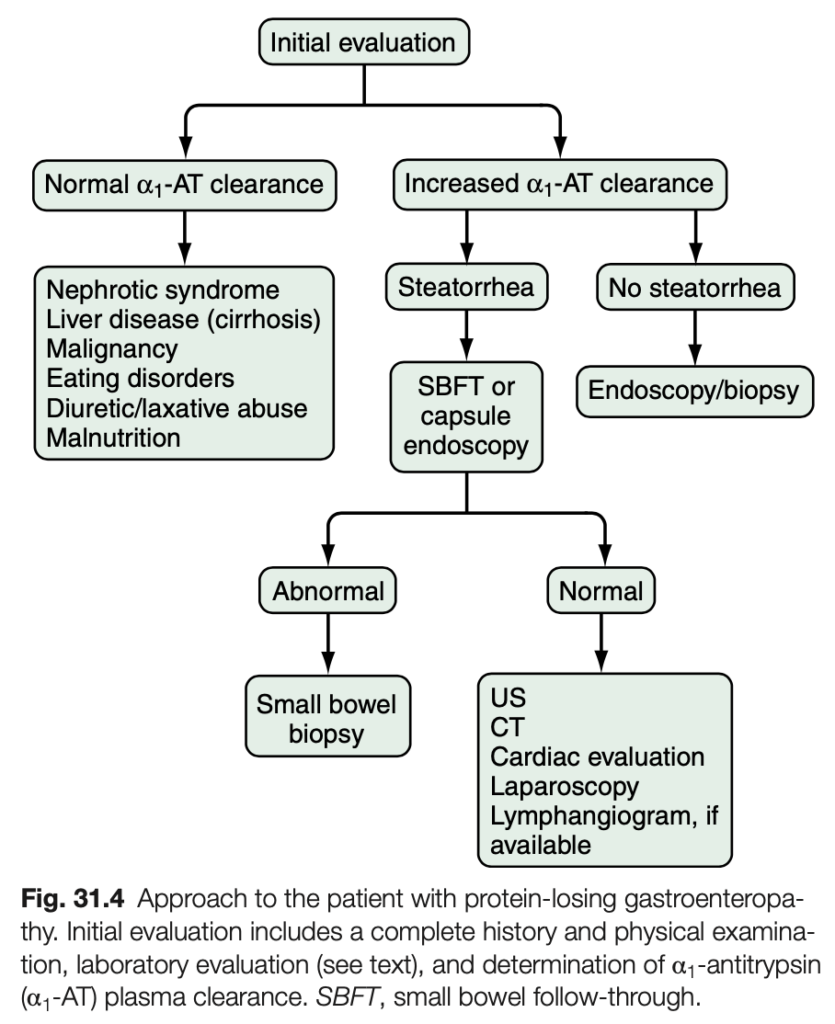
蛋白漏出性胃腸症へのアプローチ
治療
原疾患の治療が基本となる。よって原疾患の同定が重要となる。
対症療法として高タンパク食(2-3g/kg/日)、弾性ストッキングの装着などを行う。
ネフローゼ症候群・肝硬変・低栄養が否定的な低アルブミン血症(浮腫、胸腹水、心嚢水)をみたときに疑う。
原因はびらん性胃腸障害、非びらん性胃腸障害、リンパ管圧の上昇の3つに分ける。
診断にはα1-アンチトリプシンクリアランス、アルブミンシンチグラフィを用いる。
〈参考文献〉
Protein-losing gastroenteropathy.Sleisenger and Fordtran’s Gastrointestinal and Liver Disease. Vol 1. 11th ed. Philadelphia, PA: Saunders; 2021:435–441.
Protein losing enteropathy: comprehensive review of the mechanistic association with clinical and subclinical disease states. Clin Exp Gastroenterol. 2017;10:147-168. PMID: 28761367.
Protein-losing enteropathy: case illustrations and clinical review. Am J Gastroenterol. 2010;105:43-9. PMID: 19789526.
Protein-losing enteropathy: diagnosis with (99m)Tc-labeled human serum albumin scintigraphy. Radiology. 2001;219:86-90. PMID: 11274540.